



在熙宁小课-第116期 | PK统计分析——通过德曲妥珠单抗看ADC药物PK特征 中我们已经对德曲珠单抗的首次人体试验进行了介绍,本文将继续以该药物为例,共同学习德曲珠单抗的QT/QTc 间期延长临床研究中的PK统计分析。
PART 01
QT/QTc 间期延长临床研究
ICH要求所有具有系统生物利用度的非抗心律失常药物,在上市前需进行QT/QTc间期延长,以及潜在致心律失常作用的临床研究。包括全面QT研究( TQT 研究)或血药浓度-QTc(CQT )间期定量分析研究。
QT间期指的是指心室去极化和复极化的时程,即QRS波群的起点到T波终点的时程。QT间期延长是指具体情况下的QT间期相对正常QT间期有所较长。多种类别的非抗心律失常药可致QT间期延长,容易发生心律失常。最常见的是尖端扭转型室性心动过速(TdP),TdP易演变成心室纤颤并导致猝死。药物阻断hERG编码的钾离子通道,延长心肌动作电位复极化过程,在体表心电图上表现为QT间期延长。hERG钾离子通道被抑制引起的副作用是近年来药物撤市的重要原因。
QT/QTc研究的阴性结果是指最大时间匹配时的平均效应的单侧95%置信区间的上限小于10ms。该定义可以确保研究药物对QT/QTc间期的平均影响不大于5ms。当最大时间匹配差异超过这个阈值,研究结果为阳性。
德曲妥珠单抗的临床前研究显示,在体外DXd(德曲妥珠单抗的有效载荷)对10μmol/L(IC50>10 μM)的hERG通道电流无影响。对于接受单次静脉注射德曲妥珠单抗的遥测雄性食蟹猴,在高达78.8mg/kg的剂量水平下,未观察到对心血管、呼吸或中枢神经系统的影响。然而,在德曲妥珠单抗对食蟹猴的重复给药毒性研究中,在给药第26天后一只雄性动物在78.8mg/kg,大约是人体推荐剂量5.4mg/kg(基于AUC)的暴露量的17倍时,观察到PR间隔缩短和QTc延长长达50ms。为了进一步探究德曲妥珠单抗对不同HER2表达谱肿瘤患者的心脏毒性,研究者进行了一项在HER2的转移性和/或不可切除乳腺癌患者中的QT间期和药代动力学影响的研究(DS8201-A-J102,NCT03366428)。
DS8201-A-J102为多中心、开放标签、多剂量的I期研究,患者接受德曲妥珠单抗治疗6.4mg/kg,21天为一个周期,6.4mg/kg为I期研究中无剂量限制性毒性的最高剂量。
研究的主要终点为单次及多次给药后T-DXd(德曲妥珠单抗)、总抗及DXd的血药浓度和药代动力学参数:给药间隔内血药浓度-时间曲线下面积(AUCtau)、最大血药浓度(Cmax)、达峰时间(Tmax)、谷浓度(Ctrough)及基线校正后QTcF间期。次要终点为不良事件、客观缓解率、总缓解率等安全性及疗效指标。
PART 02
药代动力学和基线校正后QT间期的评估
在第1周期和第3周期给药前后采集血液样本进行药代动力学分析并计算PK参数。
分别采集筛选期、第1周期及第3周期给药前后的12导联心电图进行QTcF(使用Frederica公式校正心率的QT间期)的评估。为消除受试者的日间变异,使用时间匹配基线(Time-matched baseline)校正计算Δ QTcF。
PART 03
药代动力学结果
表1 T-DXd(德曲妥珠单抗)、总抗体和DXd的药代动力学参数

AR,accumulation ratio; AUClnf, area under the serum concentration-time curve up to infinity; AUClast,, area under the serum concentration-time curve up to the last quantifiable time; AUCtau, area under the serum concentration-time curve during the dosing interval; CL, total body clearance: Cmax, maximum serum concentration; Ctrough, trough serum concentration; HER2,human epidermal growth factor receptor 2;t1/2, terminal elimination haif-life; T-DXd, trastuzumab deruxtecan; Tmax, time to reach Cmax: Vss, volume of distribution at steady-state.
总体看,单次及多次给药后总抗体与德曲妥珠单抗的AUCtau、Cmax、Ctrough、Tmax较为相似,DXd的全身暴露量明显低于总抗体与德曲妥珠单抗。多次给药后,德曲妥珠单抗的AUC蓄积系数为1.35,表明第3周期AUCtau较第1周期增加了35%。DXd的蓄积系数最小,为1.09。第3周期与第1周期相比,德曲妥珠单抗的Cmax无明显变化,但Ctrough显著升高(6.03 vs. 11.8),总抗及德曲妥珠单抗的中位Tmax在第1和第3周期之间较相似(2h),平均消除半衰期t1/2从第1周期到第3周期略有增加(5.82 d vs. 7.40 d)。
PART 04
QTC间期结果
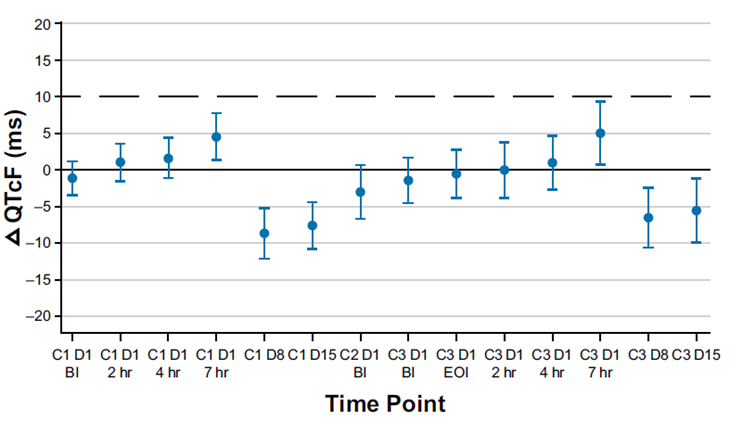
图1 时间匹配基线校正后ΔQTcF相对基线变化和双侧90%CI -时间曲线
在第1和第3周期给药后7小时,平均QTcF略有增加(图1),与第1和第3周期给予德曲妥珠单抗后DXd的Tmax大致对应(表1),90%CI的上限在所有时间点均<10ms(图1)。
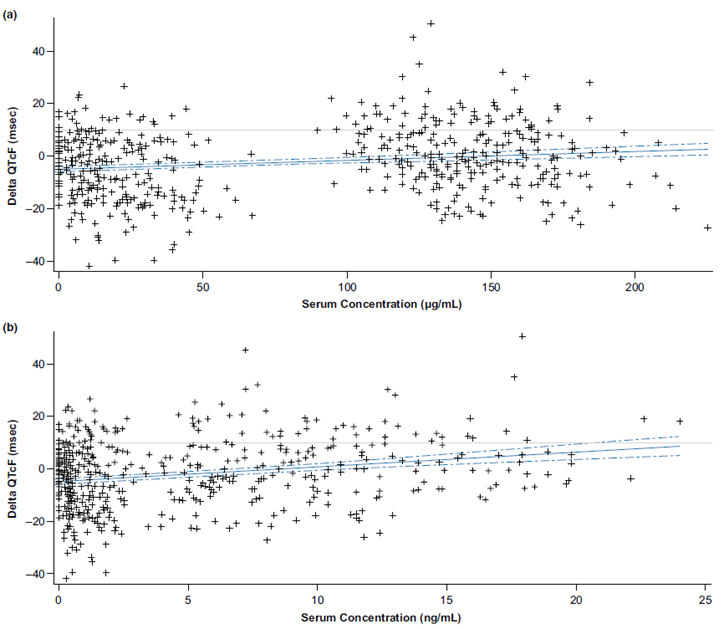
图2 ΔQTcF与(a) T-DXd和(b) DXd浓度关系
注:QTcF,Fridericia校正后QT间期;T-DXd,德曲妥珠单抗。从QTcF间期中减去每个患者的基线QTcF间期,为每个患者的每个时间点创建基线调整后的QTcF间期(第1周期至第3周期)。
实线代表给定浓度下对应的模型预测的基线校正ΔQTcF;虚线表示模型的90%置信区间。(a) ΔQTcF, T-DXd =−5.34 + 0.044 ×浓度。(b) ΔQTcF, DXd =−4.94 + 0.65 ×浓度。
浓度-QT分析显示,随着T-DXd和DXd浓度的增加,QTcF变化有轻微增加的趋势(图2)。在DXd浓度最高时,DXd浓度与ΔQTcF的90% CI上界略大于10ms(图2)。
表2 QTcF间隔与T-DXd、DXd浓度的关系
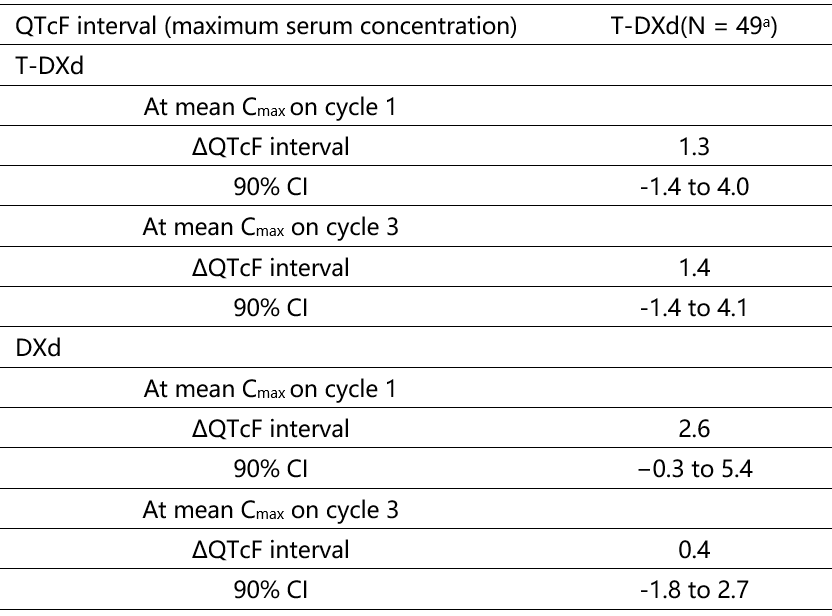
注:估计值及其90%的CI是基于模型计算的,其中浓度和基线(个体值和平均值之间的差异)是固定的协变量,测量时间是固定因素,截距和斜率作为随机效应。
在观察到的T-DXd和DXd的Cmax值上,使用线性模型方程估计QTcF的平均变化表明该值<10ms(表2)。QT和浓度-QT分析均显示,给药剂量为6.4mg/kg的T-DXd与有临床意义的QTcF延长无关(图2)。
PART 05
研究结论
研究DS8201-A-J102评估了德曲妥珠单抗对表达HER2的不可切除和/或转移性乳腺癌患者QT/QTc间期的影响,以及多次给药后的药代动力学参数。结果提示德曲妥珠单抗6.4mg/kg给药后不会产生与临床相关的QTcF延长,尽管观察到在给药后7小时QT间期有延长的趋势,但在任何时间点都没有出现临床相关的QTcF延长。此外,即使在90%CI的上限T-DXd和DXd的平均Cmax下也没有出现临床相关的QTcF延长。
T-DXd的血清浓度在研究期间达到稳态。单剂量T-DXd后,研究DS8201-A-J102评估的药代动力学参数与研究DS8201-A-J101一致。T-DXd在连续给药至第3周期时达到稳态,T-DXd的蓄积为中等而DXd的蓄积较少,可能是因为T-DXd多次给药后表达her2的肿瘤细胞数量减少,进而DXd的释放量减少。
PART 06
QT/QTc间期延长临床研究PK分析关注点
• 6.4mg/kg的给药剂量为I期研究中无剂量限制性毒性的最高剂量,高于乳腺癌治疗剂量5.4mg/kg,目的是为了针对药物的浓度-效应(QT间期)关系进行充分的探索。
• 对于ADC药物的QT间期延长研究,需要同时关注ADC药物及其效应分子的暴露与效应(QT间期)的相关性。
• 需在整个给药间隔内进行QT间期和药代动力学的评估,以表征不同暴露水平对于QT间期的影响,虽然药物的血清峰浓度并不总是与药物对QTC间期的峰值一致,但Cmax附近的QT间期仍较为重要。
PART 07
结语
熙宁生物|精翰生物基于完善的生物分析服务基础,建立了临床药理服务平台。临床药理平台可针对不同类型的临床药理研究提供PK、PD、ADA、PK/PD等统计分析服务。统计编程符合CDISC标准,统计分析流程支持各类药审机构CDE/FDA/EMA审查。
熙宁生物|精翰生物具备丰富的ADC药物检测分析服务项目经验,目前已支持超20个ADC药物管线,30多个临床试验,包括多个I期、II期、国际多中心临床研究,欢迎大家后台留言咨询交流。
参考文献
[1] ICH E14 Guideline (2015) The Clinical evaluation of QT/QTc interval prolongation and proarrhythmic potential for non-antiarrhythmic drugs.
[2] Garnett CE et al (2012) Methodologies to characterize the QT/corrected QT interval in the presence of drug-induced heart rate changes or other autonomic effects. Am Heart J 163(6):912–930.
[3] Shimomura A, et al. Effect of Trastuzumab Deruxtecan on QT/QTc Interval and Pharmacokinetics in HER2-Positive or HER2-Low Metastatic/Unresectable Breast Cancer. Clin Pharmacol Ther. 2023 Jan;113(1):160-169. doi: 10.1002/cpt.2757. Epub 2022 Oct 18.