



蛋白生物标志物的检测为患者提供了重要的临床信息,为诊断、预后和药效学提供指导。目前,常见蛋白生物标志物检测使用的体液样本(基质)包括血清、血浆(含不同类型的抗凝剂)、尿液、脑脊液、细胞裂解液、粪便等。检测时,基质的不同会影响分析的准确性和结果的可靠性,但在药物开发阶段,人们经常是根据以往的经验或文献进行基质选择,往往会忽视基质对蛋白质生物标志物定量检测的影响,未充分了解不同基质间的差异。
本文浅谈蛋白生物标志物在不同基质中的差异以及影响因素,为蛋白生物标志物检测的基质选择提供建议。
1.基于检测目的进行基质选择
临床检测中,应根据不同的生物标志物检测目的来选择不同的基质。
血清和血浆是最常用的蛋白生物标志物检测基质。血清是凝血反应后的上层淡黄色透明液体(图1)。在凝血反应中,纤维蛋白原转化为纤维蛋白,血清中不再含有纤维蛋白原,也不含血小板,具有少量的凝血因子和因凝血产生的代谢物。血浆是血液从体内取出后,加入抗凝剂进行离心后得到的上层液体(图1)。抗凝剂的存在阻断了凝血链式反应,使凝血过程受阻,因此血浆中还存在纤维蛋白原。市面上最为常见的抗凝剂包括乙二胺四乙酸(EDTA)、肝素、柠檬酸钠(又名枸橼酸)等。另外,CTAD(含柠檬酸、茶碱、腺苷和潘生丁的抗凝采血管)也常常被使用。这些抗凝剂可以防止血小板的活化和凝血的产生。总体而言,血清和血浆样本可用于各类细胞因子、趋化因子等蛋白生物标志物的检测。另外,血清样本还可用于各种病毒抗体的检查,包括丙肝病毒抗体、艾滋病病毒抗体、梅毒抗体检查以及肿瘤标记物等。血浆样本还可用于检查凝血酶的情况,通过凝血酶原时间来判断用药的剂量以及效果等。
尿液检查可以检查红细胞、白细胞和尿蛋白、尿糖、尿胆红素、HCG值等指标,从而判断是否患有肾脏类疾病、是否存在泌尿系统疾病、是否血糖血压正常、是否怀孕等情况。此外检测尿液中的尿核基质蛋白NMP22可用来辅助诊断膀胱癌。作为核基质蛋白家族成员,NMP22在癌性尿路上皮细胞中表达量丰富,在恶性细胞凋亡后释放到尿液中,导致浓度高于良性条件。
脑脊液(Cerebro-Spinal Fluid,CSF)为无色透明的液体,充满在各脑室、蛛网膜下腔和脊髓中央管内。脑脊液由脑室中的脉络丛产生,与血浆和淋巴液性质相似,略带粘性。临床上常使用腰椎穿刺术进行脑脊液抽取。脑脊液的检查对于神经系统疾病诊断有着重要的作用,例如阿尔茨海默病(Alzheimer's disease,AD)通过检测脑脊液的β淀粉样蛋白1-42(Aβ1-42)、总Tau蛋白和磷酸化Tau蛋白的含量来进行诊断。
综上所述,在临床检测中,需要根据检测目的使用不同的基质。在药物开发前期研究中,血清或血浆样本更易获得、能更直观体现药效等,因此成为使用和研究最多的生物标志物检测基质。
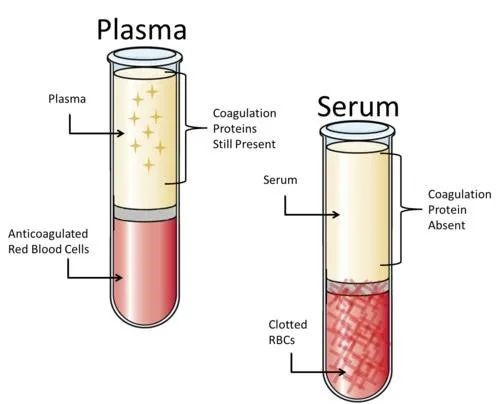
图1 血浆与血清的区别
2.蛋白生物标志物在血清与血浆中的差异
制备血清或者血浆时,需要将人体内的血液抽取出来,此时的血管内皮损伤,凝血程序被启动,血小板将被激活。血小板为盘状无核的细胞碎片,其相关蛋白质超过5000个,其中超过1000个蛋白质在血小板激活时释放。这些蛋白质分布在各种血小板颗粒中,包括致密颗粒、α颗粒和溶菌酶颗粒(例如表1示例)。
检测血小板活化和颗粒的释放,可以通过测量血小板内的蛋白质,如:ATP(致密颗粒)、血小板因子4、血管性血友病因子、人P选择素(α颗粒)、水解酶(溶菌酶)。也可通过血小板活化后激活的其他标记物来评估,如:表面人P选择素(CD62p) 、血小板衍生微粒(PMP)、血小板-单核细胞聚集体(PMA)和可溶性人P选择素。此外,通过测定聚合肌动蛋白可知血小板是否完全破裂。肌动蛋白是包括血小板在内的许多细胞中组成性表达的细胞骨架蛋白,其以单体(g型)的形式存在于血小板内,当它被释放时,会聚合(f型)并参与纤维蛋白凝块的形成。因此,它可用于监测血小板的活化/聚集。
很多临床研究证实,血清和血浆中许多蛋白生物标志物的含量是不同的。血清与血浆中的蛋白差异主要来自血小板α颗粒或循环细胞的分泌蛋白。这些分泌蛋白包括CCL5、CCL7、CCL17、CXCL5、IL-8、LCN2、PDGF-BB、TGFβ1、VEGF、TNFα和TNFSF14等。以上蛋白在血清的含量比血浆中高,可能是因为其是由(在凝血过程中)血小板α颗粒或循环细胞分泌的。其中,VEGF(vascular endothelial growth factor)称为血管内皮生长因子,是一种高度特异性的促血管内皮细胞生长因子,具有促进血管通透性增加、血管内皮细胞迁移、增殖和血管形成等作用。VEGF在肿瘤检测中发挥着重要的作用,血清中的VEGF的水平受样品中的血小板的量、样品处理方式、时间、凝血过程、温度等因素的影响,限制其在肿瘤检测中的价值;而检测血浆中的VEGF则能较为客观地反应肿瘤组织分泌VEGF的情况,故一般使用血浆作为基质进行检测 。对于凝血过程中血小板活化后释放的或循环细胞分泌的蛋白标志物检测,建议选用含少量血小板或无血小板的血浆样本。
表1: 血小板蛋白质类别

3. 肝素与EDTA血浆:不同抗凝剂的影响
血浆抗凝剂的抗凝机制大致归为两种:(1)肝素作为抗凝剂,可有效抑制凝血酶活性; (2) EDTA和柠檬酸盐螯合血液中游离的钙和镁离子,使凝血酶失去活性,中断凝血。这两种离子都是激活内源性和外源性凝血反应必需的。EDTA是一种不可逆的螯合剂,而柠檬酸的抗凝作用会因钙的添加而逆转,因此,可在柠檬酸钠的血浆中进行可控的凝血研究。
2002年,WHO发表一份报告《USE OF ANTICOAGULANTS IN DIAGNOSTIC LABORATORY INVESTIGATIONS》, 对200多种的分析物(化学物质、细胞、可溶性蛋白)进行了抗凝剂的推荐。
通过比较肝素和EDTA血浆,发现许多蛋白质的含量在两者体系中相近,但也存在某些蛋白质(如CCL5, CXCL5和CXCL11)的含量差异较大。CCL5、CCL7、CXCL11和CXCL5均为与肝素能够结合的蛋白,在肝素血浆中,这些蛋白在Ca2+的作用下与肝素结合,导致这四种蛋白质含量在肝素和EDTA血浆中的含量是不同的。若在肝素血浆中去除肝素,这些蛋白质会因肝素的缺失而使其构象发生改变,从而影响它们的检测。
此外,中心粒细胞弹性蛋白酶(neutrophil elastase, NE)会因抗凝剂的不同在血浆中呈现不同的水平,NE在肝素血浆中的含量高于EDTA血浆。从目前的研究来看,抑制剂α-1蛋白酶抑制剂(α-1PI)可与中性粒细胞弹性蛋白酶结合,形成一种抗变性复合物,使NE水解活性失活。肝素能显著降低NE与α-1PI的结合,表明肝素的存在会使 α-1PI 中释放更多的弹性蛋白酶,这可能是导致肝素血浆中中性粒细胞弹性蛋白酶水平较高的原因。此外,嗜酸性粒细胞趋化因子家族成员在肝素血浆与EDTA血浆呈现的含量也不一致,研究表明,肝素结合嗜酸性粒细胞趋化因子家族成员进而防止其在体内裂解和失活 , 而EDTA则不具有同样的效果。这些例子表明抗凝剂可能影响某些蛋白质和蛋白质-蛋白质相互作用,从而导致对蛋白质的检测结果发生改变。
生物标志物在药物开发和研究中发挥越来越重要的作用,本文对蛋白生物标志物检测的基质选择提出几点建议:1.对于检测免疫细胞中的或在凝血过程中血小板释放的蛋白标志物,建议选用含少量血小板或无血小板的血浆样本,推荐使用CTAD或者ACD抗凝剂。因为这些抗凝剂对血小板激活的影响最小;2. 慎重选择抗凝剂以减少因抗凝剂对蛋白标志物的裂解作用,因为在凝血过程中会释放或激活蛋白酶,而这些蛋白酶会降低蛋白标志物的活性和可能改变其结构;3.肝素会结合许多蛋白标志物,并改变其结构,稳定性等,因此在考虑将肝素作为抗凝剂时,也应评估潜在的影响。
参考资料
1. Dupin M, Fortin T, Larue-Triolet A, Surault I, Beaulieu C,Gouel-Chéron A, et al. Impact of serum and plasma matrices on the titration of human inflammatory biomarkers using analytically validated SRM assays. J Proteome Res.2016;15(8):2366–78.
2. Carey RN, Jani C, Johnson C, Pearce J, Hui-Ng P, Lacson E.Chemistry testing on plasma versus serum samples in dialysis patients: clinical and quality improvement implications. Clin J Am Soc Nephrol. 2016;11(9):1675–9.
3. Smith SA, Travers RJ, Morrissey JH. How it all starts: initiation of the clotting cascade. Crit Rev Biochem Mol Biol.2015;50(4):326–36.
4. Joel A. Mathews, Yan G. Ni, Connie Wang, et al.Considerations for Soluble Protein Biomarker Blood Sample Matrix Selection. The AAPS Journal (2020) 22:38.
5. Assoian RK, Sporn MB. Type beta transforming growth factor in human platelets: release during platelet degranulation and action on vascular smooth muscle cells. J Cell Biol.1986;102(4):1217–23.
6. Salanga CL, Dyer DP, Kiselar JG, Gupta S, Chance MR,Handel TM. Multiple glycosaminoglycan-binding epitopes of monocyte chemoattractant protein-3/CCL7 enable it to function as a non-oligomerizing chemokine. J Biol Chem. 2014;289(21):14896–912.
7. Seo Y, Schenauer MR, Leary JA. Biologically relevant metalcation binding induces conformational changes in heparin oligosaccharides as measured by ion mobility mass spectrometry.Int J Mass Spectrom. 2011;303(2–3):191.
8. Scholman RC, Giovannone B, Hiddingh S, Meerding JM,Malvar Fernandez B, van Dijk MEA, et al. Effect of anticoagulants on 162 circulating immune related proteins in healthy subjects. Cytokine. 2018;106:114–24.
9. Fischer JE, Janousek M, Fischer M, Seifarth FG, Blau N,Fanconi S. Effect of collection and preprocessing methods on neutrophil elastase plasma concentrations. Clin Biochem.1998;31(3):131–6.
10. Frommherz KJ, Faller B, Bieth JG. Heparin strongly decreases the rate of inhibition of neutrophil elastase by alpha 1-proteinase inhibitor. J Biol Chem. 1991;266(23):15356–62.
11. Ellyard JI, Simson L, Bezos A, Johnston K, Freeman C, Parish CR. Eotaxin selectively binds heparin: an interaction that protects eotaxin from proteolysis and potentiates chemotactic activity in vivo. J Biol Chem. 2007;282(20):15238–47.