



流式细胞术的受体占有率(receptor occupancy,RO)分析是一种稳健的分析方法,旨在识别、量化和监测治疗药物与其靶点的结合。众所周知,在药物临床研究中,RO分析可辅助剂量设定、帮助评估生物制剂最小生物效应水平、合理剂量并建立合理给药方案。RO分析可用于安全性评估,评估长期饱和RO导致的毒副作用的可能性。RO通常被视为药效学(PD)指标,与药代动力学(PK)评估相结合,用于建模PK/PD关系,是作用于细胞表面靶点的大分子药物PK/PD建模的基石。通常在设计RO的实验时,需要考虑很多因素,如测试样本的种类和条件,检测试剂的特异性及检测浓度的确认,受体表达的水平和靶细胞的丰度,靶点在给药过程中表达水平的变化和ADA的存在对RO检测的影响等等。随着新型双特异性(BsAbs)和三特异性(TsAbs)疗法的发展,它们可以识别两到三个独特的表位,需要更复杂的实验设计来确保RO的正确评估。
RO检测模式和检测原理
RO试验,一般涉及三个类型(如图1所示):“结合受体” 、“游离受体”及”总受体”,基于这三个类型,目前常用受体占有率的检测主要有两种模式:一种是通过检测结合的受体和总受体水平,计算受体占有率,通常称为“结合”模式;另一种是通过检测游离受体和总受体水平,计算受体占有率,通常称为“游离”模式。采用响应信号值(主要包括平均荧光强度、中位荧光强度和百分比等)作为报告值和计算依据。 “游离”和“结合”的分析模式及其许多变体模式已经广泛用于临床前、临床开发和上市后研究,这说明了这些分析在药物开发过程中的重要性和实用性。
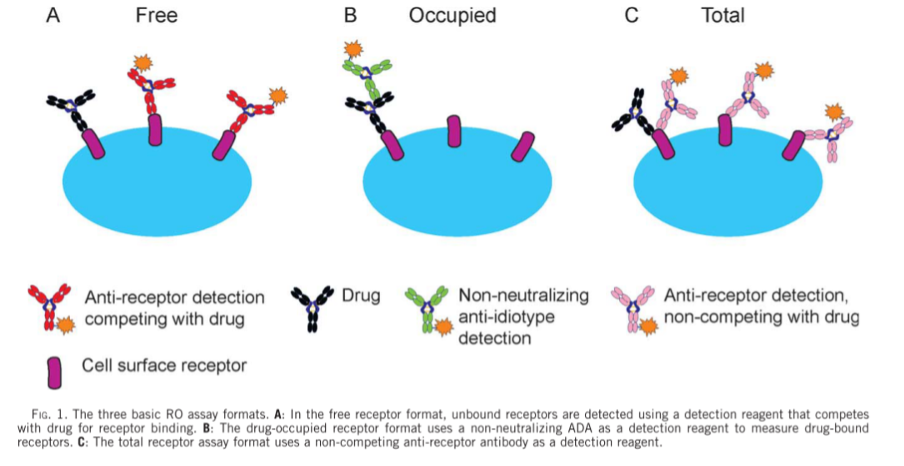
图1. RO的3种基本形式
双/三特异性抗体受体占位分析方案设计考量
对于双/三抗治疗药物的受体占位检测,若不区分受体,可采用 “结合”模式进行检测(如图2所示),“结合受体”需使用荧光素标记或者生物素标记的药物的特异性抗体来检测,”总受体”检测一般需要加入过量的药物饱和受体,然后使用荧光素标记或者生物素标记的药物的特异性抗体来检测;

图2. “结合”模式总受体检测原理
若区分受体,采用双抗药物过饱和测总受体的方法是不可取的,因其可与两/三个受体结合,因此没法确定某一受体的表达量。因此对于双/三抗区分受体的检测,“游离”模式可能是唯一的选择,需要考量的因素主要有:
(1) “游离受体”检测一般使用荧光素标记的药物,或者生物素标记的药物,配合荧光素标记的链霉亲和素使用(如图3所示)。荧光素标记或者生物素标记抗体或者蛋白是实验室的常规操作,仅需要很少的资源即可获得。其质量和稳定性可靠,可获得足够的量,并且明确可与药物竞争结合受体。
“游离受体”检测也可采用与药物竞争且亲和力相当或低于药物与受体结合亲和力的竞争性抗体(非荧光素标记的药物)来检测,即结合同一受体的相同表位(如图3所示)。前提是筛到这样的抗体,相对于用荧光素标记药物检测的方法,该方法人力成本和试剂成本都要高一些,因此第一种方式是比较容易实现的,开发和验证一种检测方法,具备较高的成本优势。

图3. “游离”模式检测原理
对于可逆结合的靶点,随着检测抗体浓度不断增加,药物与靶点间存在竞争置换的可能,因此需要对检测抗体的浓度进行充分摸索,以寻找最优检测抗体浓度(如图4所示)。
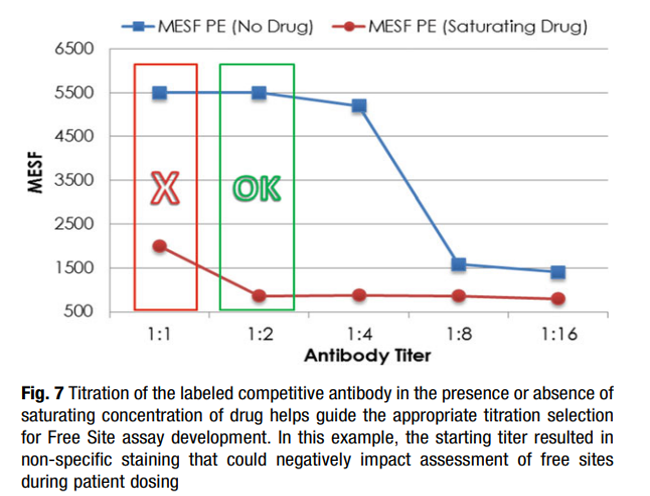
图4. 检测抗体的滴定
(2)”总受体”的检测,采用非竞争抗体来检测。非竞争抗体,即一种与药物结合同一受体,又与药物互不干扰的检测抗体。实际工作中,寻找商业化的可用的非竞争性试剂来评估总受体是有一定难度的,需要花费很多的时间和财力,甚至可能找不到这样的试剂。若是未筛选到药物的非竞争性抗体,总受体检测可以对给药前的样本进行药物的过饱和处理测得总受体水平,但由于受体/靶点在给药过程中,可能会发生受体/靶点上调或下调(内化或脱落等),给药后受体的表达水平发生变化(如图5所示),可能会高估或低估RO。另外,如果对于一些表达丰度比较低的受体,无法通过圈门得出阳性比例,只能通过平均荧光强度(MFI)或荧光强度中位值(MdFI)计算得到给药后不同时间点的RO,而这两个值会受仪器状态、设置、分析人员和实验室等影响,因此测定的给药前总受体水平在一定程度上可能不能真实反馈实际给药后的总受体水平。

图5. 给药后受体调节机制
(3) “自由模式”容易受到ADA和Nab的影响,尤其是使用全血进行RO检测时。如下图6所示,由于有Nab的产生,加入的检测试剂被Nab识别中和,因此不能结合到受体上,最后造成过高的估计药物的RO水平。而图7指的是另外一种情况,由于存在ADA,ADA与药物结合,进而ADA的另外一端可以和标记的药物结合,或者ADA两端都可以和标记的药物结合,造成信号放大,造成过低的估计药物RO水平,进而影响实验结果的准确性。使用与药物分子没有同源序列但与药物竞争结合受体的抗体或许可以避免这个问题。
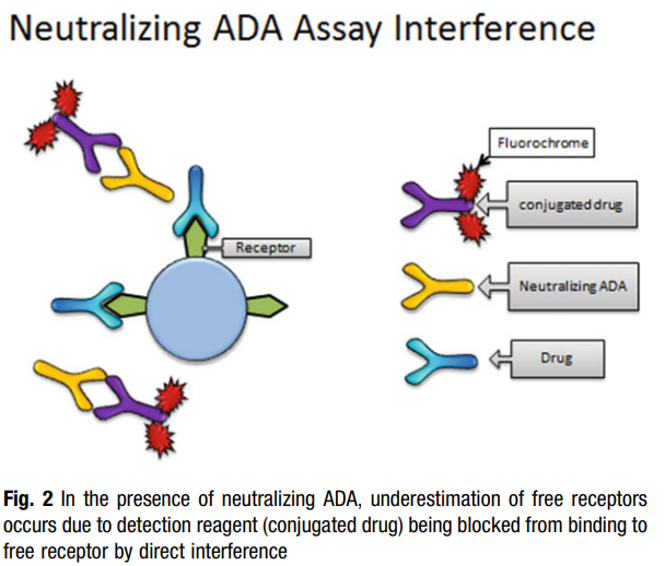
图6. 中和的ADA可能对RO检测造成的影响
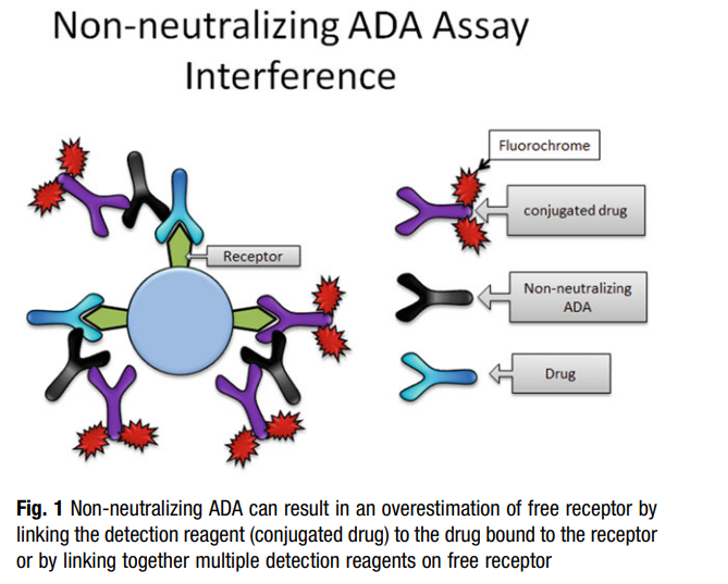
图7. 非中和的ADA可能对RO检测造成的影响
案例分享
熙宁生物有着丰富的基于流式细胞术检测双/三特异性抗体受体占位的临床项目经验,开发了多个双/三特异性抗体药的受体占位检测方法,部分项目经验如下:
1.某双抗药物检测试剂浓度摸索的部分数据:
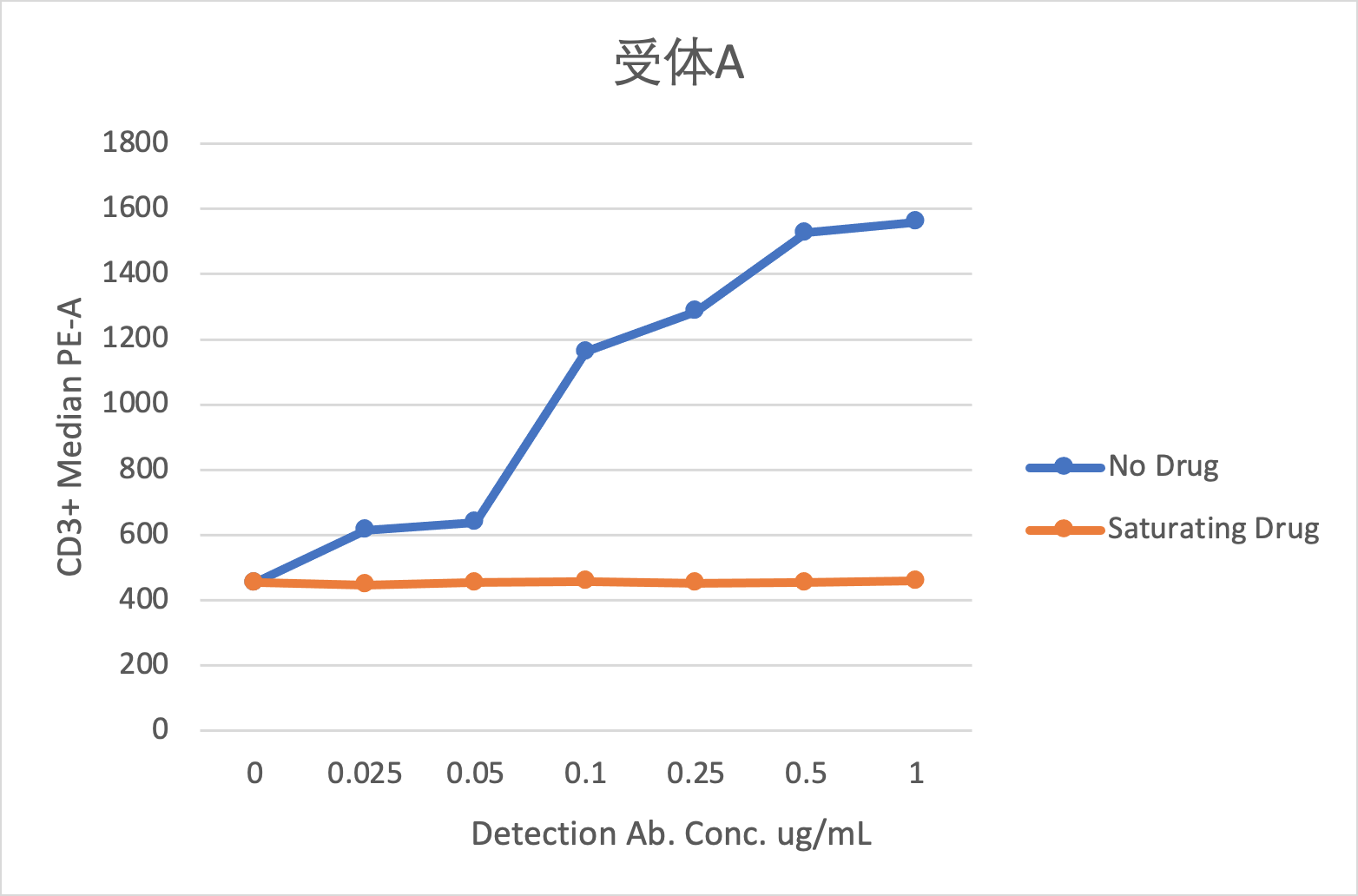
图8 A. 受体A检测试剂浓度滴定
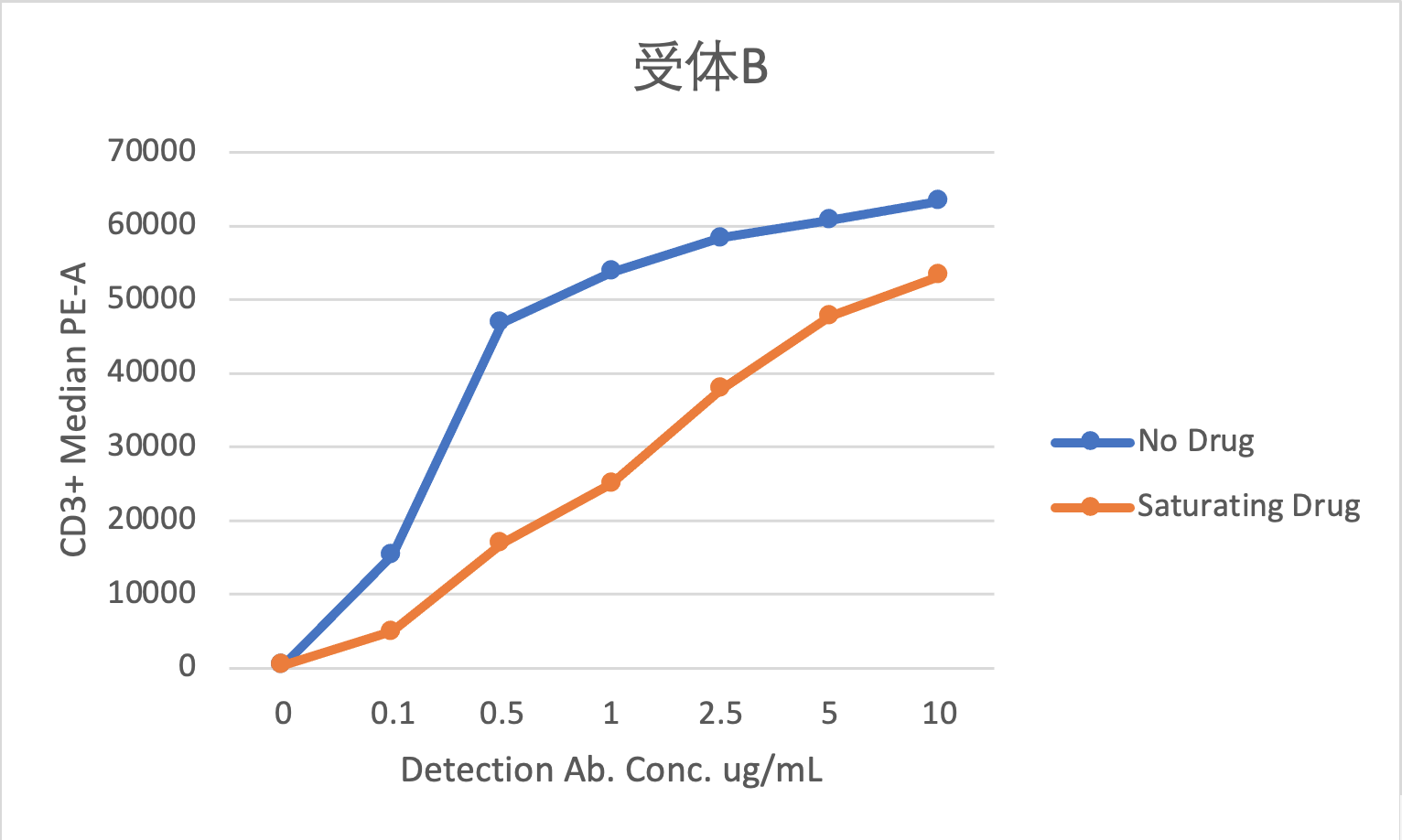
图8 B. 受体B检测试剂浓度滴定
图8是某双抗药物的受体占位检测试剂浓度滴定的数据,从图上可以看出,对于受体A,检测抗体与药物竞争不明显,可以用于检测游离受体;对于受体B,检测抗体与药物竞争明显,不能用于检测游离受体。
表1 受体A RO%稳定性数据
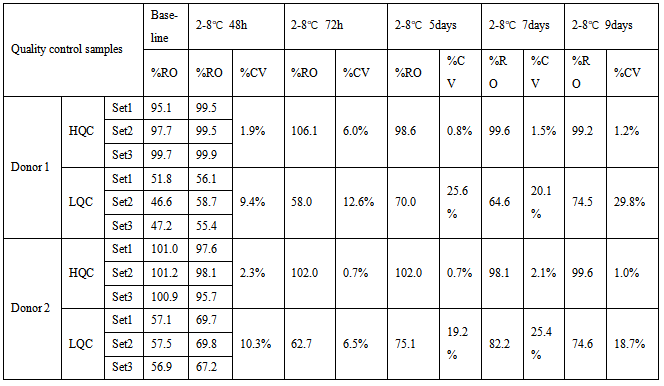
表2 受体B RO%稳定性数据
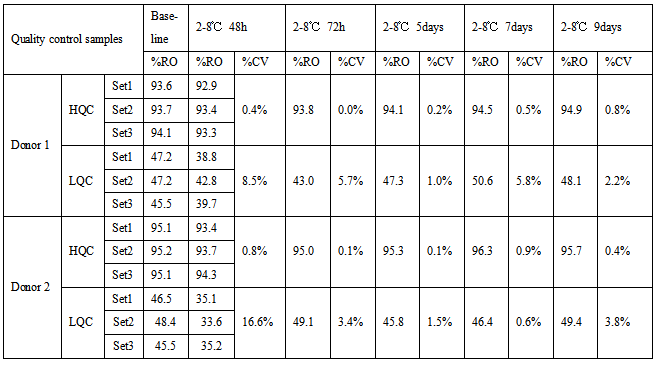
表3 受体A和受体B的总的RO%的稳定性数据
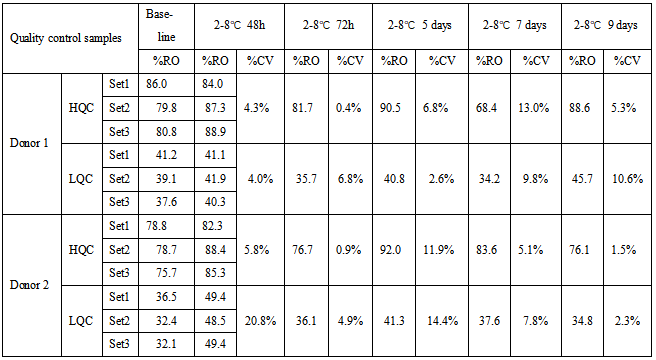
表1、2和3中,由于两个受体的表达丰度不一样,表中HQC和LQC不能通用,分开配制,加药浓度根据不同检测项有所调整。HQC和LQC样品在2-8℃保存9天,均满足接受标准CV≤30%。
4. 参考文献
1.Liang,M., et al., Receptor occupancy assessment by flow cytometry as a pharmacodynamic biomarker in biopharmaceutical development. Cytometry B Clin Cytom, 2016. 90(2): 117-127.
2.基于流式细胞技术的受体占有率检测方法的建立及验证内容探讨。中国医药工业杂志,2019, 50(9):1024-1028.
3.基于流式细胞术的受体占位实验设计的研究现状。中国临床药理学杂志,2020, 36(14):2148-2152.
4.Audia, Alessandra, et al. "Flow cytometry and receptor occupancy in immune-oncology." Expert Opinion on Biological Therapy 22.1 (2022): 87-94.
5.Fu, Jie, et al. "Receptor occupancy measurement of anti-PD-1 antibody drugs in support of clinical trials." Bioanalysis 11.14 (2019): 1347-1358.
6.Stewart, Jennifer J., et al. "Role of receptor occupancy assays by flow cytometry in drug development." Cytometry Part B: Clinical Cytometry 90.2 (2016): 110-116.
7.Flye-Blakemore, Leanne, et al. "Precision Medicine: The Function of Receptor Occupancy in Drug Development." Immuno-Oncology. Humana, New York, NY, 2020. 167-197.
8.Green, Cherie L., et al. "Recommendations for the development and validation of flow cytometry‐based receptor occupancy assays." Cytometry Part B: Clinical Cytometry 90.2 (2016): 141-149.