



核酸药物根据其结构和作用机制可分为四类:反义寡核苷酸类 (ASO)、小干扰RNA类(siRNA)、适配体类(Aptamer)和信使RNA类 (mRNA),其中前三类统称为小核酸药物。
小核酸药物是指分子量较小的单链或双链核酸,一般由少于30个的碱基(对)组成,主要通过碱基互补配对原则作用于细胞内的mRNA,调控蛋白质的表达,从而治疗因蛋白水平异常而引起的各类疾病。

图1 核酸药物分类示意图
(Front Bioeng Biotechnol. 2021; 9: 628137.)
小核酸药物是与小分子药物、抗体药物完全不同的全新药物类别,利用靶细胞内天然存在的转录和翻译机制发挥作用,无需复杂的蛋白质工程生产,具有设计简便,研发周期短,候选靶点丰富等优势。
表1 核酸药物与抗体、小分子药物对比


图2 小核酸药物将靶点从蛋白水平扩展到RNA和DNA水平
(Pharmacol Rev. 2020 Oct; 72(4): 862–898.)
20世纪80年代初,抑制蛋白质合成的反义寡核苷酸 (ASOs)促进了小核酸药物的快速发展。进入21世纪,RNAi和siRNA的应用拓展了小核酸药物范围,其它多种RNA调节因子和相关机制也逐步得到充分的验证。

图3 小核酸药物主要发展进程
(Cell Death and Disease (2022) 13:644.)
目前全球已有十余种小核酸药物获批上市,如下所示:
表2 已上市小核酸药物
(Exp Mol Med. 2022 Apr; 54(4): 455–465.)

PART 01
反义寡核苷酸类(ASO)疗法
ASO为18-30nt个碱基组成的单链RNA,可通过碱基互补配对与靶标mRNA的特定序列结合,但已批准的ASO药物可分为两大类。
1、ASO通过结合靶序列诱导靶mRNA的裂解;
2、ASO主要通过基于位阻的机制来调节pre- mRNA的剪接。

图4 ASO作用机制(Exp Mol Med. 2022 Apr; 54(4): 455–465.)
Nusinersen是由Ionis和Biogen合作开发一款明星产品,用于治疗SMN1基因缺失或失活突变,导致运动神经元存活蛋白 (SMN)水平较低,形成的脊髓性肌萎缩症(SMA)。人类基因组中存在SMN2基因,与SMN1高度同源,区别在于SMN2基因外显子7的调控序列被异质核核糖核蛋白(hnRNP)的结合所掩盖,因此在翻译时相比SMN1缺少外显子7,会产生大量无功能且不稳定的蛋白质。
Nusinersen作为ASO药物,能够与SMN2外显子7的调控序列结合,取代hnRNP,从而翻译形成全长的SMN蛋白,增加功能性SMN蛋白的水平,改善患者的运动神经元功能并减缓疾病进展。

图5 Nusinersen作用机制
(Exp Mol Med. 2022 Apr; 54(4): 455–465.)
PART 02
小干扰RNA(siRNA)疗法
siRNA是长度为21-25 nt与靶基因互补的小片段双链RNA,进入细胞后先形成RISC前体,然后被切断并解离得到RISC复合物,该复合物中保留的siRNA引导链与靶标 mRNA结合,引导 RISC 切断该mRNA,抑制蛋白合成。
RISC 复合物切断靶mRNA后 ,可回收利用,单个 siRNA可在多轮mRNA切割中循环使用。
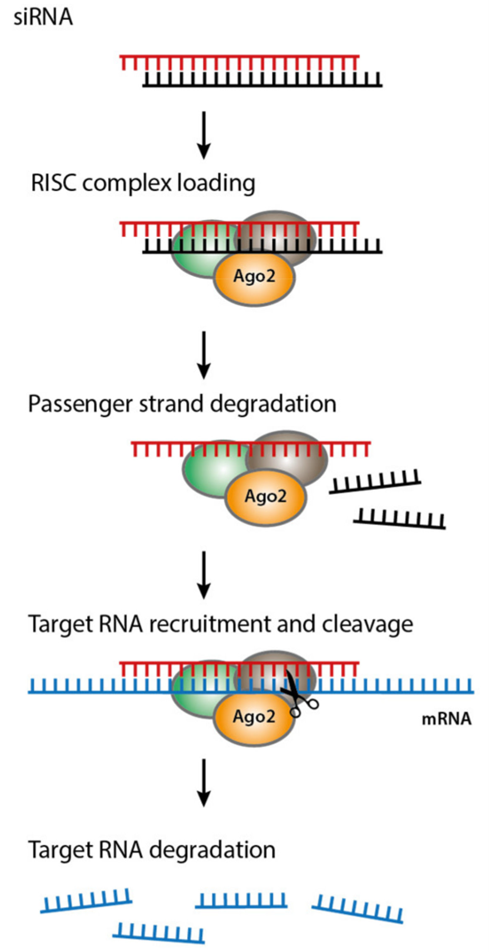
图6 siRNA作用机制(Biomedicines . 2021 May 14;9(5):550.)
Inclisiran是一款由Alnylam公司开发的用于高脂血症的siRNA疗法,通过将靶向PCSK9的双链siRNA与GalNAc偶联,使其特异性进入肝脏组织,从源头上阻断PCSK9的表达,从而降低LDL-C的水平,实现降脂的治疗目的。

图7 Inclisiran作用机制(Exp Mol Med. 2022 Apr; 54(4): 455–465.)
PART 03
适配体(aptamer)疗法
Aptamer为20-70个碱基组成的单链DNA或RNA,经过自身卷曲、折叠形成特定的三维构型,并通过范德华力、氢键、静电作用、碱基堆积力等,利用其空间结构与靶标高亲和性、高特异性地结合。由于Aptamer具有良好的靶向性能,并且其三维结构可以携带药物,因此其具有成为药物载体的潜力。
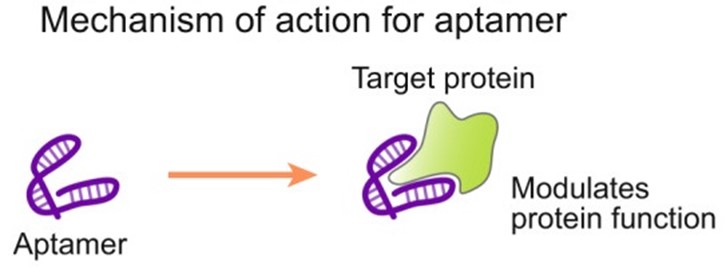
图8 Aptamer作用机制
(Exp Mol Med. 2022 Apr; 54(4): 455–465.)
PART 04
信使RNA (mRNA)疗法
外源mRNA进入体内后,由自体细胞表达出特定的蛋白质,通过内源表达功能蛋白来发挥其治疗作用。
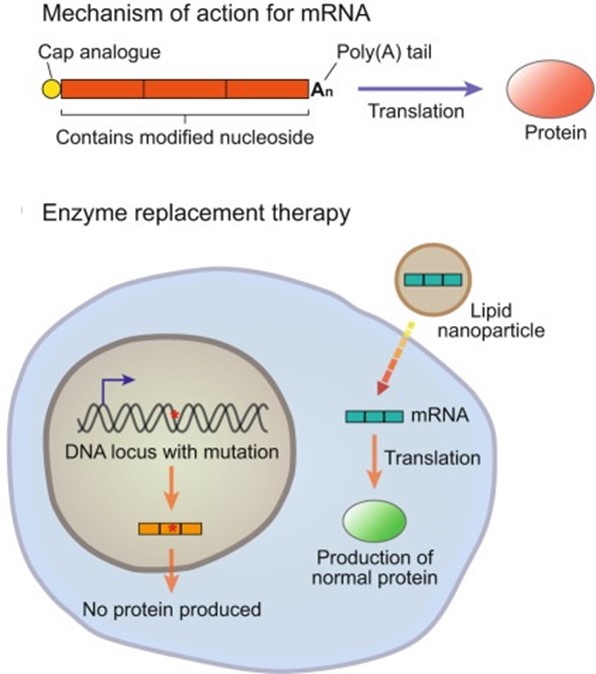
图9 mRNA作用机制
(Exp Mol Med. 2022 Apr; 54(4): 455–465.)
编码抗原序列的mRNA疫苗通过脂质纳米载体等递送平台被引入细胞,然后通过翻译产生抗原,激活免疫反应。

图10 mRNA疫苗作用机制
(Exp Mol Med. 2022 Apr; 54(4): 455–465.)
PART 05
RNA递送系统
RNA疗法的递送仍然面临巨大的挑战,现有递送方式可分为添加靶向片段、脂质纳米颗粒包封RNA片段以及不经修饰直接给药到靶器官。

图11 RNA药物递送途径
(Exp Mol Med. 2022 Apr; 54(4): 455–465.)
RNA药物具有亲水性和负电荷,不能跨越细胞膜扩散,需要递送载体和/或化学修饰才能达到其靶标。当系统给药时,RNA递送系统需要保护RNA免受血清核酸酶的侵害以及免疫系统清除,避免与血清蛋白的非特异性相互作用,并阻断肾脏清除。虽然免疫原性和核酸酶等生物屏障通常通过化学修饰RNA来解决,但将RNA封装到纳米载体中既可以保护RNA又可以将RNA传递到细胞中。

图12 RNA纳米载体(Med. Chem. 2022, 65, 6975−7015.)
PART 06
寡核苷酸在大脑的定位递送
局部定位注射是RNA药物递送的有效手段,定量检测RNA药物在靶点器官内的分布和摄取,是该类药物体内药理的关键。
通过侧脑室定位注射将RNA药物递送至大脑,定时检测药物在脑部的分布。

图13 小鼠脑部荧光
PART 07
结语
熙宁生物|精翰生物临床前药理药效平台具有丰富的CDX模型、Syngeneic 模型、免疫完全肿瘤模型。非肿瘤模型具有丰富的炎症和自勉模型、代谢疾病模型、疼痛和CNS相关疾病模型。我们以分析科学为核心,建设有完善的检测分析平台,包括ELISA、WB、FACS、MSD、LC-MS/MS、ELISpot、EnVision、Simoa 、Cell Assay、qPCR、IHC/IFC、Sysmex XN、PK、Tox和血液分析等,来支持RNA等药物的临床前药理药效评价。欢迎大家后台留言咨询交流。