



随着PD-1/PD-L1免疫治疗的发展,PD-L1免疫组化检测作为生物标志物也越来越受到重视,那不同的PD-1/PD-L1抗体药物中,PD-L1免疫组化检测使用的抗体和检测平台各不相同,在药物研发中应如何选择合适的PD-L1抗体呢?
PART 01
为什么要进行PD-L1检测?
免疫治疗已在多种肿瘤的治疗中显示出有效性和安全性,并被广泛应用,已成为恶性肿瘤治疗新的里程碑。然而,并不是所有患者都能从免疫治疗中获益,因此需要借助特定的生物标志物来筛选适宜人群和预测免疫治疗的疗效。PD-L1、微卫星不稳定、肿瘤突变负荷、肿瘤浸润性淋巴细胞等生物标志物被证实具有一定的预测价值,其中PD-L1表达是目前应用最广的免疫治疗生物标志物。
随着临床实践数据的积累,PD-1/PD-L1抑制剂在多种肿瘤中均被证实有效,现已用于包括肺癌、食管癌、胃癌、尿路上皮癌、肝癌、结直肠癌、乳腺癌、经典型霍奇金淋巴瘤及恶性黑色素细胞瘤等肿瘤的治疗之中。一系列临床研究结果证实肿瘤细胞或肿瘤相关免疫细胞的PD-L1表达水平与免疫治疗疗效及患者预后密切相关。PD-L1作为预测免疫治疗药物疗效的标志物,对于免疫治疗药物的应用具有伴随诊断(companion diagnostics)和补充诊断(complementary diagnostics)的价值。
PART 02
PD-L1检测有哪些平台方法?
免疫组织化学检测PD-L1表达作为抗PD-1/PD-L1治疗的预测性生物标志物,需遵循药物-疾病-诊断分析(drug-disease-diagnosis,3D)原则,临床试验的设计是针对特定的疾病类型、选用了特定的免疫治疗药物以及特定的PD-L1免疫组织化学检测方法,根据分层分析结果筛选出了获益人群,同时PD-L1免疫组织化学判读阈值是经过临床实践验证的。所以,不同类型免疫治疗药物对应的PD-L1检测试剂盒不尽相同,与疗效相关的PD-L1阳性判读阈值亦不尽相同。
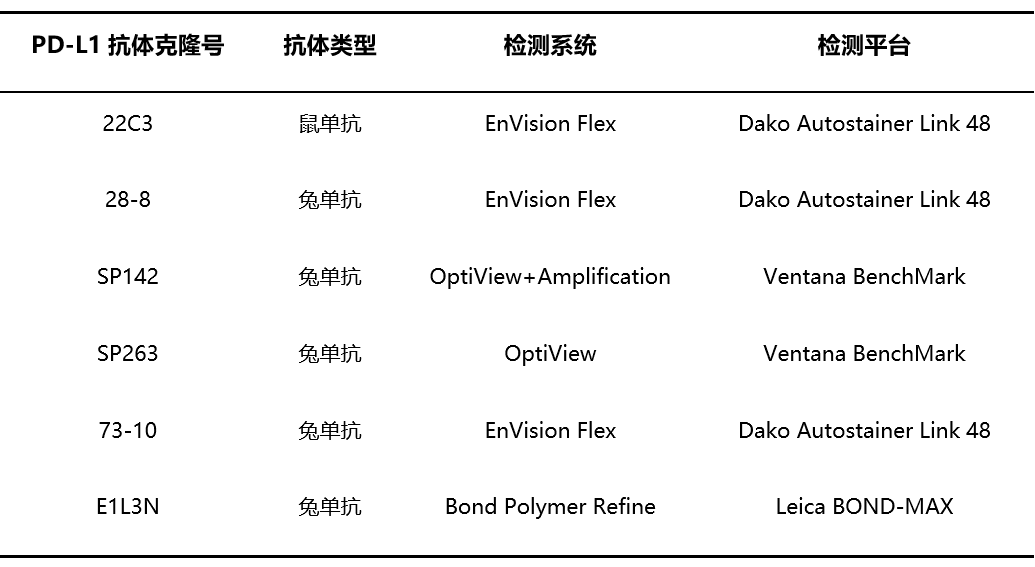
PD⁃L1免疫组织化学抗体需与配套的检测系统在对应的检测平台中进行:目前有多个PD-L1 免疫组织化学检测抗体试剂盒,如22C3 pharmDx(Dako)、28-8 pharmDx (Dako)、SP142(Ventana)、SP263(Ventana)、73-10(Dako)及E1L3N(CST),在3个免疫组织化学平台(Dako Autostainer Link 48、Ventana BenchMark、Leica Bond 免疫组织化学全自动染色系统)进行检测。除了73-10外,其他5种抗体都已经在国内获批。
表1 PD-L1免疫组织化学检测试剂盒及配套的检测系统、检测平台[1]
PART 03
22C3-K药背后的伴随抗体
帕博利珠单抗商品名为 Keytruda(可瑞达),由于通用名过于拗口,中文肿瘤界经常称为K药,即使在国内很多大型正式肿瘤会议,很多与会专家也将其称为K药,可见国内整个肿瘤学界对K药的一致认可。
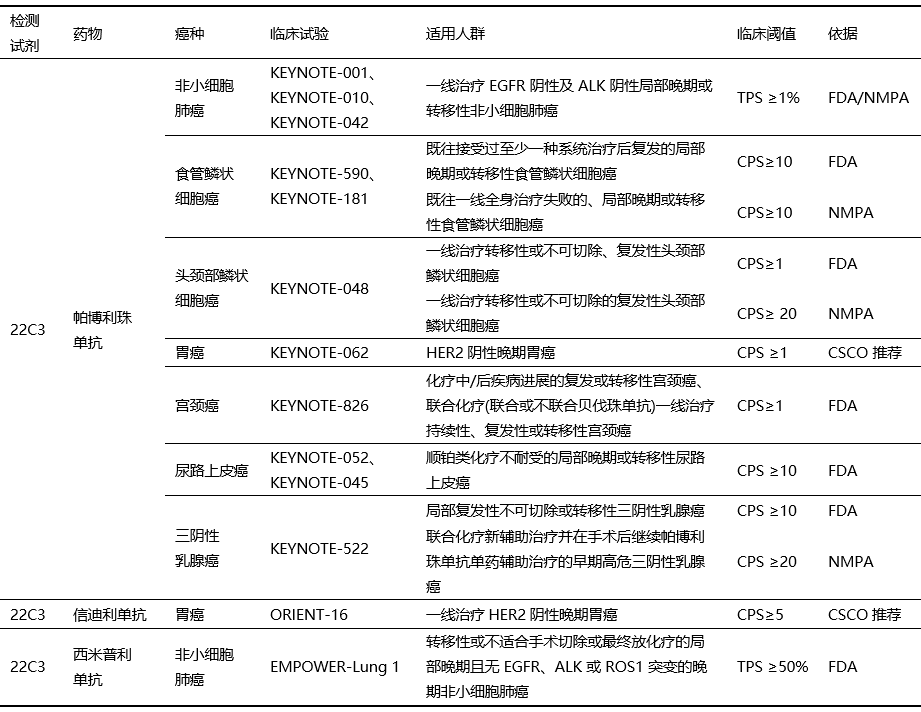
22C3在临床开展最早的KEYNOTE-001研究是一项针对接受帕博利珠单抗治疗的晚期NSCLC患者的I期临床试验, NSCLC扩展队列研究总共入组495例患者,包括182例训练集和313例验证集人群。该研究采用22C3抗体检测患者PD-L1的表达,在训练集人群选择不同的PD-L1 cut-off值及多种评分系统评估生物标志物,通过ROC曲线转折点确定PD-L1 cut-off值为 TPS≥50%,之后在验证集人群确认PD-L1 TPS≥50%人群疗效更好且总生存期延长。随后的KEYNOTE-010研究也采用PD-L1表达分层,研究显示在伴有PD-L1阳性(TPS≥1%)的转移性NSCLC中,帕博利珠单抗可以作为二线治疗,OS有显著改善。而KEYNOTE-042研究进一步将人群标准扩大至 PD-L1 TPS≥1%,结果提示与化疗相比,帕博利珠单抗显著降低死亡风险, NMPA于2019年批准其一线适应证,适用于PD-L1 TPS≥1%的EGFR及ALK阴性NSCLC患者。
后续多个临床试验中PD-L1表达检测都使用了22C3抗体,并基于PD-L1表达分层分析的疗效数据在不同适应症中形成了临床cut-off值(表2)。
表2 PD-L1 22C3抗体在不同瘤种中的临床诊断cut-off值[1]
PART 04
28-8-O药背后的伴随抗体
纳武利尤单抗商品名为欧狄沃,由于纳武利尤单抗这个通用名过于拗口,大家经常口语化的以“欧狄沃”或“O药”称呼,与“K 药”并称为“OK双雄”。
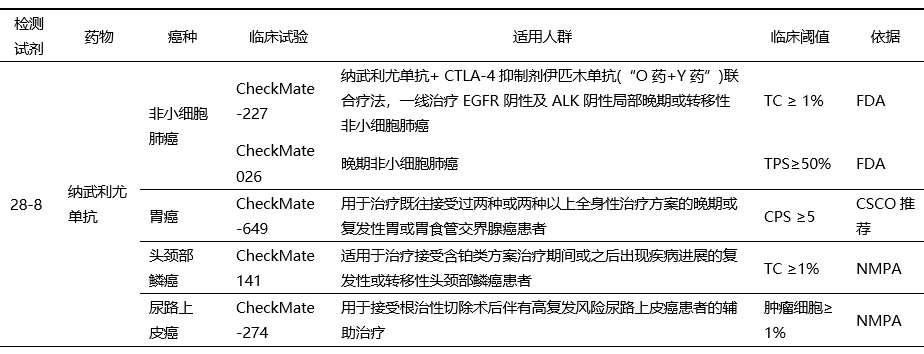
基于CheckMate -227的临床试验结果,2020年5月,美国FDA批准了PD-1抑制剂纳武利尤单抗+ CTLA-4抑制剂伊匹木单抗(“O药+Y药”)联合疗法用于一线治疗EGFR或ALK阴性且肿瘤表达PD-L1(≥1%)的转移性非小细胞肺癌成人患者。
CheckMate-274研究显示,在PD-L1表达肿瘤细胞≥1%的患者中,纳武利尤单抗将疾病复发或死亡风险降低54%,基于此研究结果,2023年1月,纳武利尤单抗获批用于接受根治性切除术后伴有高复发风险尿路上皮癌(UC)患者的辅助治疗,成为我国首个且唯一获批用于UC辅助治疗的 PD-1 抑制剂。
后续针对多个适应症的临床试验中PD-L1表达检测都使用了28-8抗体,并基于疗效数据在不同适应症中形成了临床cut-off值(表3)。
表3 PD-L1 28-8抗体在不同瘤种中的临床诊断cut-off值[1]
PART 05
SP263-应用广泛的抗体
基于BGB-A317-204的II期研究,2020年4月10日,PD-1抑制剂替雷利珠单抗新适应症获NMPA批准,用于治疗接受含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性PD-L1高表达的尿路上皮癌(UC)患者,SP263为替雷利珠单抗的伴随诊断检测试剂。
根据PACIFIC的研究结果,在总生存期的亚组分析中,除了PD-L1表达阴性(TC<1%)的患者,其他亚组都更倾向于使用度伐利尤单抗进行治疗。
下表中列出了部分PD-L1表达检测使用SP263抗体的临床试验,及基于PD-L1表达分层分析的疗效数据形成的临床cut-off值(表4)。
表4 PD-L1 SP263抗体在不同瘤种中的临床诊断cut-off值[1]

PART 06
SP142-阿替利珠单抗背后的抗体
阿替利珠单抗(泰圣奇)在临床试验设计时,为了使获益人群更广,疗效不受检测抗体的限制,分别使用了SP142、22C3及SP263抗体进行IHC检测,检测的患者分别有554例、534例及546例,结果提示不论是SP142、22C3或SP263抗体检测,都能观察到PD-L1高表达患者从阿替利珠单抗治疗中实现稳定的OS获益。2021年4月29日,PD-L1抑制剂阿替利珠单抗(泰圣奇)获得NMPA批准用于PD-L1高表达(TC≥50%或IC≥10%)晚期非小细胞肺癌(NSCLC)患者的一线治疗。
基于IMpower132的研究结果,2021年6月22日, NMPA批准免疫药物PD-L1抗体阿替利珠单抗新适应症,此次获批的适应症为:联合培美曲塞和铂类化疗用于无 EGFR 突变和无ALK突变的转移性非鳞非小细胞肺癌患者的一线治疗。
下表中列出了部分PD-L1表达检测使用SP142抗体的临床试验,及基于PD-L1表达分层分析的疗效数据形成的临床cut-off值(表5)。
表5 PD-L1 SP142抗体在不同瘤种中的临床诊断cut-off值[1]

PART 07
E1L3N-最新国产伴随抗体
E1L3N抗体为最新获NMPA批准的国产PD-L1表达检测试剂,用于非小细胞肺癌患者组织切片中PD-L1蛋白的表达检测,伴随的药物为帕博利珠单抗。
总结
此篇内容主要介绍了PD-L1免疫组化检测5种常见抗体的应用,可以看出同一适应症不同药物对应的PD-L1检测试剂盒不同,与疗效相关的PD-L1阳性判读阈值亦不相同,那么不同抗体间检测的结果是否可以互用,阳性判读阈值是否可以互用?下篇将针对这些问题,详细介绍不同抗体互用性比较结果及熙宁生物|精翰生物PD-L1检测服务,敬请期待。
参考文献
[1] 实体肿瘤PD-L1免疫组织化学检测专家共识(2021版)
[2] Kang SP, Gergich K, Lubiniecki GM, et al. Pembrolizumab KEYNOTE-001: an adaptive study leading to accelerated approval for two indications and a companion diagnostic. Ann Oncol. 2017;28(6):1388-1398. doi:10.1093/annonc/mdx076
[3] Downs-Canner S, Mittendorf EA. Preoperative Immunotherapy Combined with Chemotherapy for Triple-Negative Breast Cancer: Perspective on the KEYNOTE-522 Study [published correction appears in Ann Surg Oncol. 2023 Apr 4;:]. Ann Surg Oncol. 2023;30(6):3166-3169. doi:10.1245/s10434-023-13267-z
[4] Lu S, Fang J, Wang Z, et al. Primary results from the China Cohort of IMpower132: atezolizumab (atezo) + carboplatin (carbo) or cisplatin (cis) + pemetrexed (pem) as first-line therapy in advanced NSCLC[EB/OL]. ELCC 2021, abstract 102P.
[5] 102P - Primary results from the China Cohort of IMpower132: atezolizumab (atezo) + carboplatin (carbo) or cisplatin (cis) + pemetrexed (pem) as first-line therapy in advanced NSCLC
[6] Hirsch FR, McElhinny A, Stanforth D, et al. PD-L1 Immunohistochemistry Assays for Lung Cancer: Results from Phase 1 of the Blueprint PD-L1 IHC Assay Comparison Project. J Thorac Oncol. 2017;12(2):208-222. doi:10.1016/j.jtho.2016.11.2228
[7] Tsao MS, Kerr KM, Kockx M, et al. PD-L1 Immunohistochemistry Comparability Study in Real-Life Clinical Samples: Results of Blueprint Phase 2 Project. J Thorac Oncol. 2018;13(9):1302-1311. doi:10.1016/j.jtho.2018.05.013
[8] Ahn S, Lee Y, Kim JW, et al. Programmed cell death ligand-1 (PD-L1) expression in extrahepatic biliary tract cancers: a comparative study using 22C3, SP263 and E1L3N anti-PD-L1 antibodies. Histopathology. 2019;75(4):526-536. doi:10.1111/his.13901
[9] Munari E, Zamboni G, Lunardi G, et al. PD-L1 expression in non-small cell lung cancer: evaluation of the diagnostic accuracy of a laboratory-developed test using clone E1L3N in comparison with 22C3 and SP263 assays. Hum Pathol. 2019;90:54-59. doi:10.1016/j.humpath.2019.05.003
[10] Zhang W, Cao Z, Gao C, et al. High concordance of programmed death-ligand 1 expression with immunohistochemistry detection between antibody clones 22C3 and E1L3N in non-small cell lung cancer biopsy samples. Transl Cancer Res. 2020;9(10):5819-5828. doi:10.21037/tcr-20-101
[11] Song L, Zeng L, Yan H, et al. Validation of E1L3N antibody for PD-L1 detection and prediction of pembrolizumab response in non-small-cell lung cancer. Commun Med (Lond). 2022;2(1):137. Published 2022 Nov 1. doi:10.1038/s43856-022-00206-4
[12] Smith J, Robida MD, Acosta K, et al. Quantitative and qualitative characterization of Two PD-L1 clones: SP263 and E1L3N. Diagn Pathol. 2016;11(1):44. Published 2016 May 18. doi:10.1186/s13000-016-0494-2
[13] Smith J, Robida MD, Acosta K, et al. Quantitative and qualitative characterization of Two PD-L1 clones: SP263 and E1L3N. Diagn Pathol. 2016;11(1):44. Published 2016 May 18. doi:10.1186/s13000-016-0494-2
[14] 中国非小细胞肺癌PD-L1表达检测临床病理专家共识[J]. 中华肿瘤杂志,2020,42(7):513-521.
[15] Zhou YJ, Li G, Wang J, et al. PD-L1: expression regulation. Blood Sci. 2023;5(2):77-91. Published 2023 Jan 13. doi:10.1097/BS9.0000000000000149
[16] Patel SP, Kurzrock R. PD-L1 Expression as a Predictive Biomarker in Cancer Immunotherapy. Mol Cancer Ther. 2015;14(4):847-856. doi:10.1158/1535-7163.MCT-14-0983
[17] Tsao MS, Kerr KM, Kockx M, et al. PD-L1 Immunohistochemistry Comparability Study in Real-Life Clinical Samples: Results of Blueprint Phase 2 Project. J Thorac Oncol. 2018;13(9):1302-1311. doi:10.1016/j.jtho.2018.05.013