



PD-L1免疫组化检测—神药背后的英雄系列
自从PD-1/PD-L1抗体药物上市以来,PD-L1免疫组化伴随诊断检测越来越多的应用到临床中。同时,在药物临床试验过程中,也引起了较多的关注。这里我们介绍一下PD-L1免疫组化检测的一些关键点,为大家在临床应用过程中提供一些参考。
PD-L1在不同组织中的表达是怎样的?
PD-1是一种叫做“程序性死亡受体1”的蛋白,主要表达在T细胞表面,它可以与肿瘤细胞表面的PD-L1结合,抑制T细胞对肿瘤细胞的杀伤作用,从而导致肿瘤免疫逃逸的结果。PD-1/PD-L1抗体药物可以阻断这种相互结合,恢复T细胞对肿瘤的杀伤作用,从而起到治疗癌症的效果。所以,肿瘤组织中PD-L1的表达与PD-1药物的疗效有着很大的相关性。
PD-L1在多种肿瘤中广泛表达,不同肿瘤中的PD-L1表达水平不同。如下图所示,胸腺癌和弥漫大B 细胞淋巴瘤的 PD-L1 阳性率最高(51%–58%),而腺样囊性癌和阑尾肿瘤样本均无 PD-L1 阳性[1]。
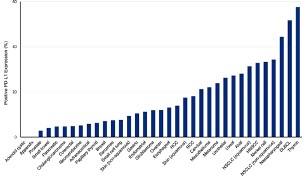
图片来自Mark Yarchoan et al. Journal of clinical investigation Insight 2019;
PD-L1检测抗体主要有哪些?
PD-L1检测常用的克隆主要有 22C3,28-8,SP263, SP142,73-10,E1L3N等[2]。除了73-10外,其他克隆都已经在国内获批。
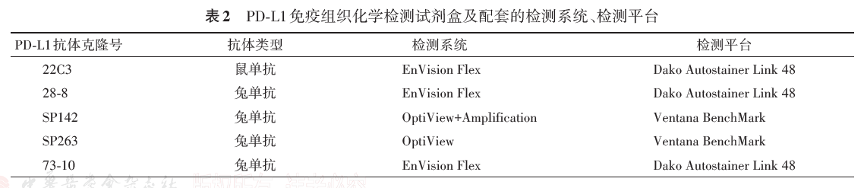
来自实体肿瘤PD-L1免疫组织化学检测专家共识(2021版)
22C3来自于Dako公司,是来源于小鼠的单克隆抗体,需要匹配Dako Autostainer Link 48免疫组化染色机平台。2015 年 10 月,22C3率先获得美国 FDA批准,用于NSCLC的检测,从此开启了 PD-L1 伴随诊断的临床之路,在国内也于2019年8月获批,是目前最为公认的,使用最广泛的的PD-L1克隆。主要原因是其获证最早,适应症最广,伴随药物是K药,因此成就了22C3在PD-L1检测中的地位。正因为炙手可热,因此也是目前使用价格最高的PD-L1 IHC检测抗体。
SP263由罗氏公司生产,是来源于兔的单克隆抗体,需要配合罗氏的BenchMark Ultra全自动免疫组化染色机使用,是伴随PD-1药物最多的PD-L1检测抗体。包括默沙东的K药,施贵宝的O药,以及百济神州的替雷丽珠单抗等。主要获批的适应症是非小细胞肺癌和尿路上皮癌。
不同抗体间的一致性如何?
根据蓝印计划的结果显示,22C3,28-8,SP263之间的一致性较好。如下图所示,73-10的染色结果明显强于22C3,而SP142明显弱于22C3[3]。因此,当22C3不可用或者需要控制成本时,推荐使用SP263或者其他科研抗体,如CST的E1L3N,而对于73-10和SP142两个克隆的使用需较为谨慎。
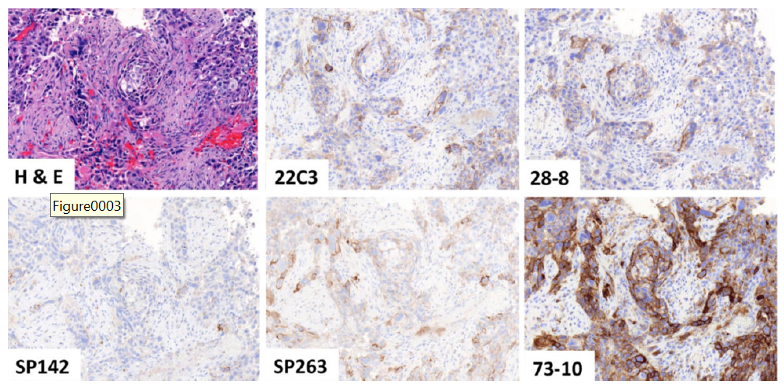
图片来自J Thorac Oncol. 2018 Sep;13(9):1302-1311.
另外, 2017年AZ发起的一项研究也显示,22C3,28-8,SP263的一致性较好,总体一致率超过90%[4]。
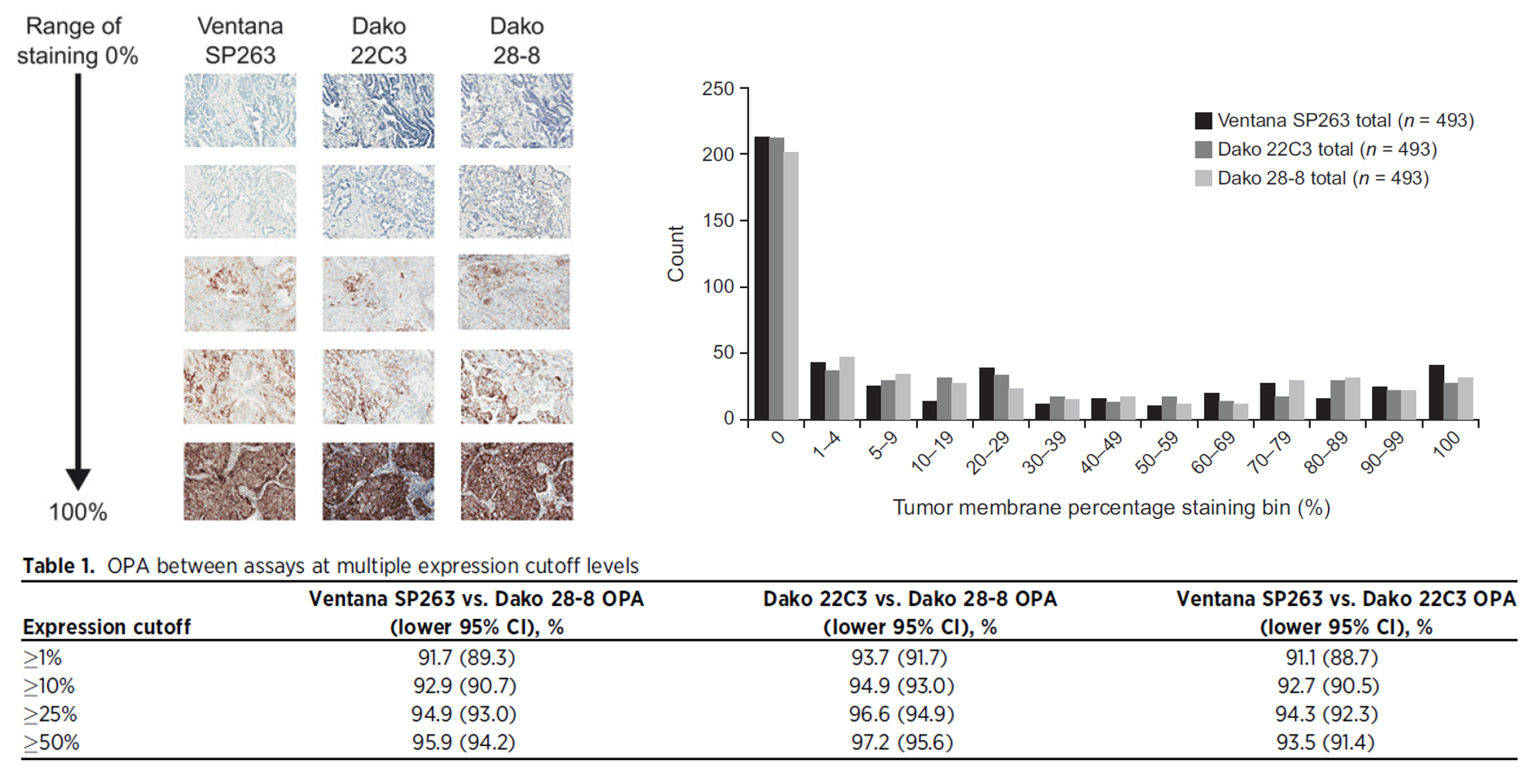
PD-L1检测体系的确定?
免疫组织化学检测PD-L1表达作为抗PD-1/PD-L1治疗的预测性生物标志物,国内外专家一致推荐,需根据药物-疾病-诊断分析(3D)原则进行选择,即PD-L1免疫组织化学抗体需与配套的检测系统在对应的检测平台中进行,不能随意更换。

3D原则
目前临床上,PD-L1 检测主流方式是 4 种克隆号对应 2 种检测平台。当进行 PD-L1 检测时,首先要保证不同克隆号的 PD-L1 在相应的检测平台上进行,这样才能保证检测结果的准确性和可重复性。如下图所示,同样是28-8的抗体,在不同平台上的检测结果强弱也是有明显差异的[5]。所以在对应的平台上进行检测是十分必要的。
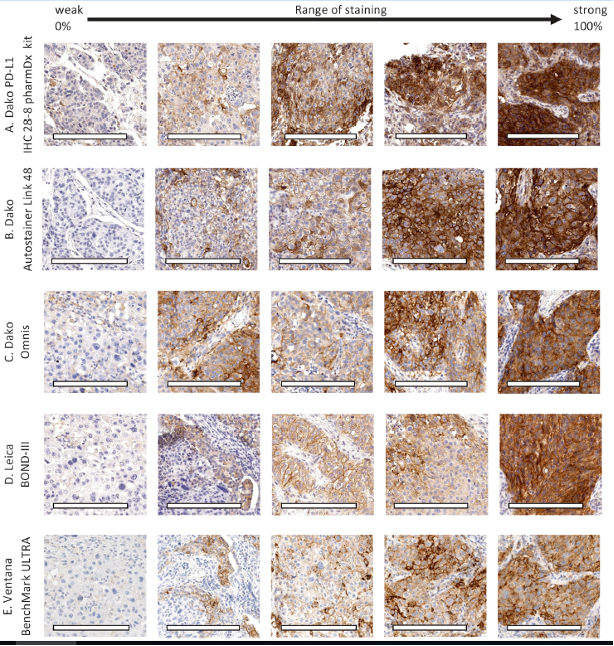
图片来自于Mod Pathol. 2018 Nov;31(11):1630-1644.
样本类型有哪些?
PD-L1的检测标本主要是石蜡标本,来源主要包括:一是手术切除标本;二是支气管镜、经皮穿刺的活检标本;三是胸水等包埋的细胞块标本。
手术组织标本:
手术标本应选择病变组织的代表性蜡块进行PD⁃L1检测,应避免选择含有坏死组织、挤压细胞及固定不佳等标本块。有研究表明,同一肿瘤多个蜡块之间PD⁃L1表达率一致性较高。
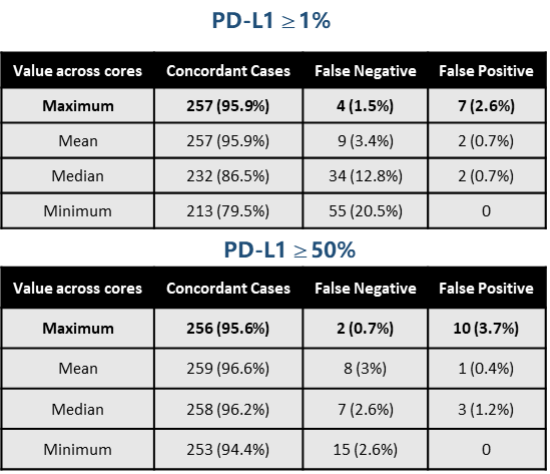
用于PD-L1 IHC检测的组织样本保存时间不能超过3年。在ATLANTIC研究中(如下表),研究者对比了≤3年和>3年所获得的肿瘤标本PD-L1表达情况,结果显示,≤3年内获得的标本与近期获取的标本之间PD-L1表达率一致性较高,而存储时间>3年的标本中PD-L1高表达比例明显下降[6]。
Archival Time | < 3 mon | ≥ 3 months to 1 year | 1 - 3 years | > 3 years |
PD-L1 Expression rate | 32.8% | 32.8% | 29.1% | 13.3% |
NO. of Patient | 1191 | 118 | 173 | 83 |
J Clin Oncol, 2016, 34(15 suppl): 3025.
穿刺样本:
活检标本数量会显著影响PD-L1表达检测的准确性。多个研究表明,穿刺样本需要至少穿3-4条,才能达到90%以上的一致率。至于在多条穿刺样本中怎么选择,有研究表明(如下表所示),在穿刺的多条样本中PD-L1表达值最高的活检标本与手术标本的一致性最高[7]。
J Thorac Oncol (IF: 15.61; Q1). 2018 Aug;13(8):1113-1120.
细胞学标本:
有研究表明,在TPS 50%一档,活检样本和细胞块相比组织样本,有更高的阳性率。因此,采用细胞学样本与组织学样本的一致性不是很好[8]。同时,使用细胞蜡块的时候,在实际检测中,往往视野中细胞数量过少,且不容易区分是否为肿瘤细胞。因此,各大专家共识和指南不推荐使用细胞学样本。
原发灶与转移灶标本:
晚期恶性肿瘤患者,临床上无法获取原发肿瘤组织,可在获得的转移灶中进行PD⁃L1检测。当同时获得原发灶及转移灶标本时,推荐均进行PD⁃L1检测,并分别报告检测结果。一项纳入了35个配对样本的研究结果显示,当检测原发灶和转移性淋巴结样品进行检测时,PD-L1的表达显示了显著的差异,如下图。尤其是高表达的样本中,差异更为明显。该研究表明,淋巴结转移样本的检测结果不能代表原发灶的PD-L1表达情况,尤其是淋巴结转移样本的阴性结果,如果采用很有可能造成漏检[9]。
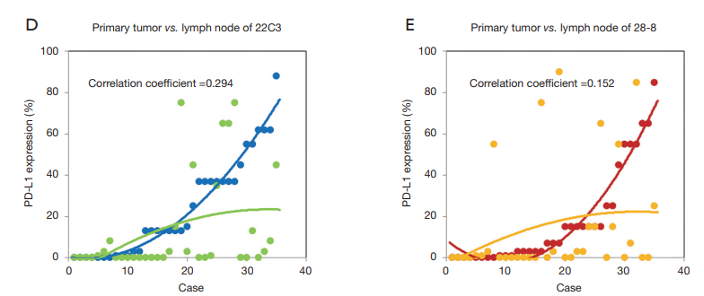
J Thorac Dis (IF: 2.9; Q3). 2019 Dec;11(12):4982-4991.
扁桃体和胎盘在PD-L1免疫组化检测中有什么作用?
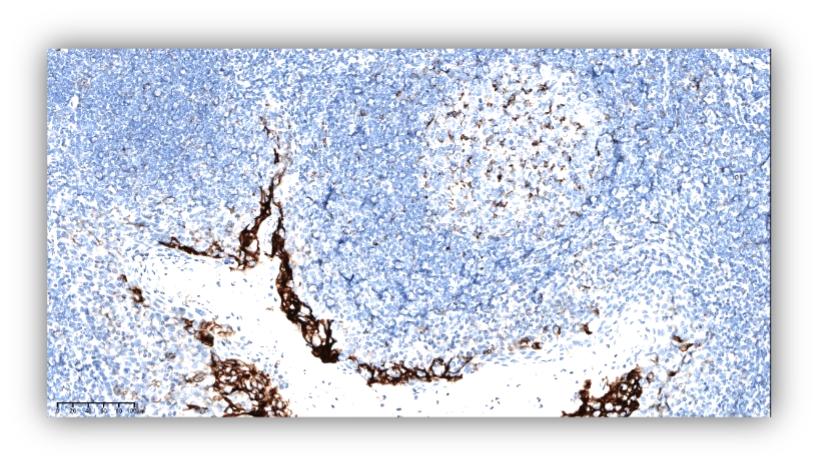
扁桃体
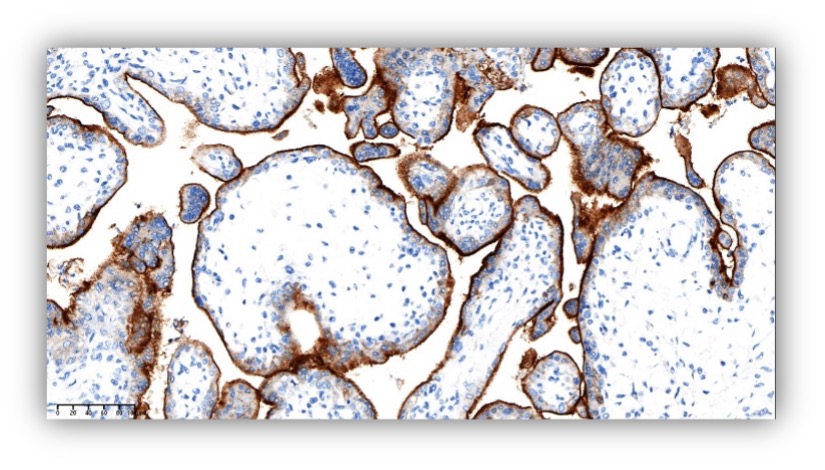
胎盘
图片来自于熙宁生物病理实验室
扁桃体和胎盘常用于PD-L1检测的质量控制。主要原因是扁桃体的隐窝上皮细胞呈现中等到强的染色,生发中心巨噬细胞呈现弱到中等强度的点状胞膜染色,淋巴细胞(外套层和生发中心B细胞)和浅表上皮细胞无染色。胎盘滋养层细胞呈现中到强的膜染色,胎盘绒毛内间质和脉管无染色。所以,扁桃体和胎盘作为PD-L1检测的批次质控是目前最为常用的。除此之外,有条件的实验室也可以选择阳性表达PD-L1的细胞系作为PD-L1检测的质控品。每个检测批次,需要添加一个批次质控。只有当批次的质控品有准确的结果,相应的批次检测结果才能够被接受。
总之,PD-L1免疫组化检测在目前的药物研发和PD-1药物的伴随诊断中起了非常重要的作用。要想获得准确的检测结果,必须要对检测过程的各个方面进行较为深入的了解和研究,同时,需要与申办方和医院一起严格控制相应的关键点,才能确保结果精准可靠,经的起推敲。
参考文献:
1.Yarchoan M, Albacker LA, Hopkins AC, Montesion M, Murugesan K, Vithayathil TT, Zaidi N, Azad NS, Laheru DA, Frampton GM, Jaffee EM. PD-L1 expression and tumor mutational burden are independent biomarkers in most cancers. JCI Insight. 2019 Mar 21;4(6):e126908.
2.实体肿瘤PD-L1免疫组织化学检测专家共识(2021版)
3.Tsao MS, Kerr KM, Kockx M, Beasley MB, Borczuk AC, Botling J, Bubendorf L, Chirieac L, Chen G, Chou TY, Chung JH, Dacic S, Lantuejoul S, Mino-Kenudson M, Moreira AL, Nicholson AG, Noguchi M, Pelosi G, Poleri C, Russell PA, Sauter J, Thunnissen E, Wistuba I, Yu H, Wynes MW, Pintilie M, Yatabe Y, Hirsch FR. PD-L1 Immunohistochemistry Comparability Study in Real-Life Clinical Samples: Results of Blueprint Phase 2 Project. J Thorac Oncol. 2018 Sep;13(9):1302-1311.
4.Ratcliffe MJ, Sharpe A, Midha A, Barker C, Scott M, Scorer P, Al-Masri H, Rebelatto MC, Walker J. Agreement between Programmed Cell Death Ligand-1 Diagnostic Assays across Multiple Protein Expression Cutoffs in Non-Small Cell Lung Cancer. Clin Cancer Res. 2017 Jul 15;23(14):3585-3591.
5.Koppel C, Schwellenbach H, Zielinski D, Eckstein S, Martin-Ortega M, D'Arrigo C, Schildhaus HU, Rüschoff J, Jasani B. Optimization and validation of PD-L1 immunohistochemistry staining protocols using the antibody clone 28-8 on different staining platforms. Mod Pathol. 2018 Nov;31(11):1630-1644.
6.Midha A, Sharpe A, Scott M, et al. PD-L1 expression in advanced NSCLC: Primary lesions versus metastatic sites and impact of sample age. J Clin Oncol, 2016, 34(15 suppl): 3025.
7.Munari E, Zamboni G, Lunardi G, Marchionni L, Marconi M, Sommaggio M, Brunelli M, Martignoni G, Netto GJ, Hoque MO, Moretta F, Mingari MC, Pegoraro MC, Inno A, Paiano S, Terzi A, Cavazza A, Rossi G, Mariotti FR, Vacca P, Moretta L, Bogina G. PD-L1 Expression Heterogeneity in Non-Small Cell Lung Cancer: Defining Criteria for Harmonization between Biopsy Specimens and Whole Sections. J Thorac Oncol. 2018 Aug;13(8):1113-1120.
8.Wang H, Agulnik J, Kasymjanova G, Wang A, Jiménez P, Cohen V, Small D, Pepe C, Sakr L, Fiset PO, Auger M, Camilleri-Broet S, Alam El Din M, Chong G, van Kempen L, Spatz A. Cytology cell blocks are suitable for immunohistochemical testing for PD-L1 in lung cancer. Ann Oncol. 2018 Jun 1;29(6):1417-1422.
9.Saito Y, Horiuchi S, Morooka H, Ibi T, Takahashi N, Ikeya T, Shimizu Y, Hoshi E. Inter-tumor heterogeneity of PD-L1 expression in non-small cell lung cancer. J Thorac Dis. 2019 Dec;11(12):4982-4991.