



T细胞的激活检测指标
T淋巴细胞(T lymphocyte)简称T细胞,来源于骨髓的淋巴干细胞,在胸腺中分化、发育成熟后,通过淋巴和血液循环分布到全身免疫器官和组织中发挥免疫功能。它具有多种生物学功能,如直接杀伤靶细胞,辅助或抑制B细胞产生抗体,对特异性抗原和促有丝分裂原的应答反应以及产生细胞因子等,是身体中为抵御疾病感染、肿瘤发生而形成的英勇斗士。
T细胞产生的免疫应答是细胞免疫, T 淋巴细胞活化是免疫应答的核心。活化的T细胞表面表达CD69、CD25、CD38、CD71和HLA-DR等分子,Ki67的表达与CD71正相关。激活后早期(30-60 min)检测到CD69基因的转录表达,但在4-6 h后迅速下降;CD69蛋白表达早在刺激2-3 h后就能检测到。因此CD69被广泛用作早期活化的标记物。体外T细胞的活化可以用anti-CD3和anti-CD28的抗体或磁珠,PHA,PMA等刺激。
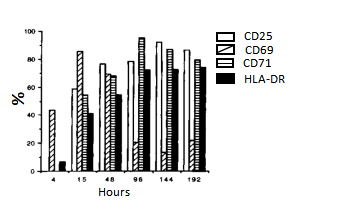
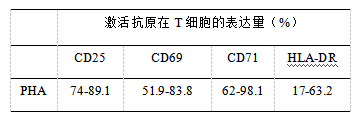
使用PHA体外刺激PBMC,然后将PBMC置于37℃,含有7%的CO2的培养箱中继续培养,检测不同时间点CD3阳性细胞群中CD25,CD69,CD71和HLA-DR的表达,结果如图1, CD69是最早检测到的分子,在15 h达到峰值,之后随着时间延长,表达量降低;CD25和CD71在刺激15 h才可以被检测到,并分别于刺激后144 h和96 h达到峰值,HLA-DR在刺激后的峰值表达量最低,HLA-DR,CD25和CD71在刺激后可在较长一段时间维持较高的表达。激活抗原表达量如表1。
除上文所述的T细胞激活指标,CD38和Ki67也是T细胞的活化抗原,且Ki67的表达与CD71的表达呈正相关。用Anti-CD3/CD28抗体体外刺激PBMC,CD4+和CD8+细胞上的CD25,CD69,CD38,CD71和Ki67刺激后各时间点的表达量如图2和图3。刺激早期就可以检测到CD69的表达,在刺激4 h内可以检测到CD25,CD71,CD38的表达,但是Ki67在刺激4 h未见明显增加;刺激后6 h,CD8+细胞群的CD25,CD69和CD38表达量显著上调,在CD4+细胞群中这些活化抗原表达量未见明显变化,Ki67在CD4+和CD8+细胞群中表达量都显著上调;刺激后24 h,CD4+和CD8+细胞群中的CD25和CD69表达都大于90%,CD71和Ki67在CD8+细胞群的表达明显高于其在CD4+中的表达;刺激后48 h,CD25,CD69, CD71和Ki67在CD4+和CD8+细胞群的表达量均达到90%以上且一直持续到72 h(除CD69),CD69的表达在刺激后72 h则呈下降趋势;CD38在CD8+细胞群的表达于刺激后48 h达到90%以上,而在CD4+细胞群则在刺激后72 h达到90%以上。
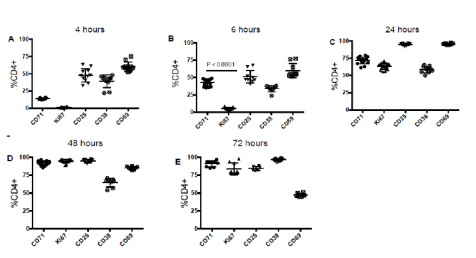
图2
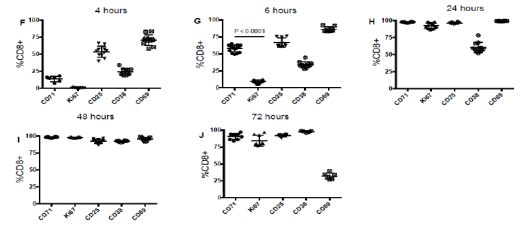
图3
临床应用案例
在喉癌患者中,肿瘤组织中的早期活化抗原CD69和CD71表达高于健康人的上皮组织,晚期活化抗原CD25与健康人的表达量无明显差异,另一晚期活化抗原HLA-DR在肿瘤组织的表达量高于健康人,用PHA分别刺激肿瘤组织细胞和健康人上皮细胞后的结果与不刺激的结果类似,如下 表2。
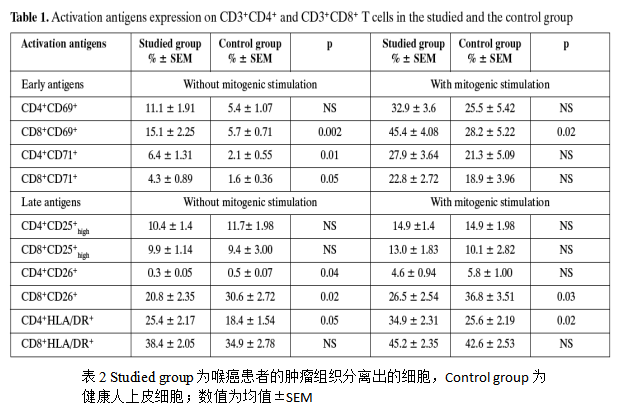
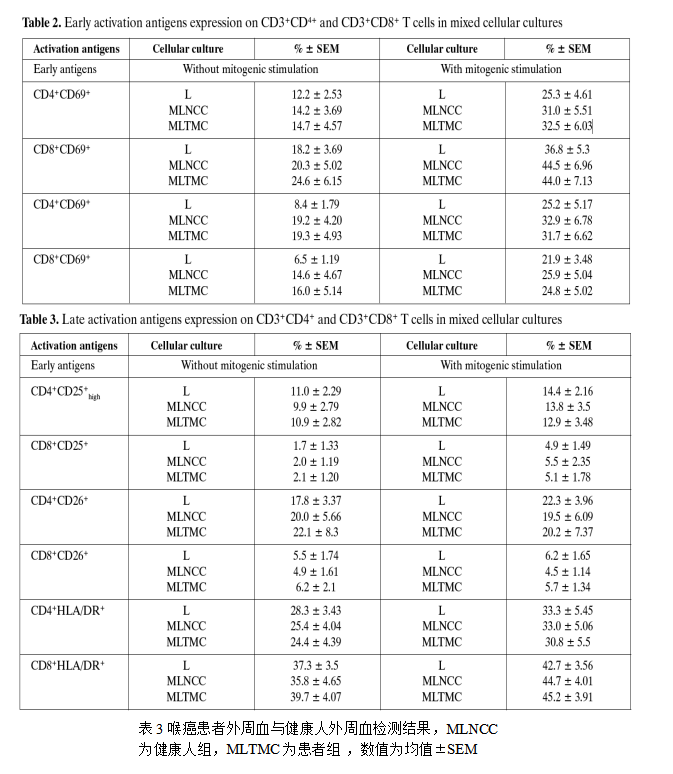
外周血中CD4+和CD8+细胞群的活化抗原表达与肿瘤组织表达差异较大,在喉癌患者的外周血中,CD69,CD71和HLA-DR在CD8+细胞群中的表达略高于健康人,在CD4+细胞群中的表达则无明显差异,CD25的 表达在CD4+和CD8+细胞群中均与健康人无差异,如下表3.
对于T细胞激活以及免疫系统激活类型的药物,如IL2类药物及多特异性抗体、IL15类药物及多特异性抗体、CD3类的多特异性抗体,靶向OX40、CD40、4-1BB等的激动剂类抗体,以及药物作用中会减少Treg亚群,进而可能造成免疫系统的激活的药物类型,进行T细胞激活检测指标的检测,都是一项重要的药效或者安全性指标。部分信息可以参考之前的公众号文章《单抗激动剂药物应该如何做临床PD检测——以OX40单抗为例》。
熙宁生物在支持药物的临床分析中,已经积累的大量经验,已经完成和正在进行的临床研究有十余个。已经积累了丰富的经验,主要包括:
1.基于流式细胞术的T细胞激活指标分析,包括4-1BB,CD69,HLA-DR,CD25等亚群占比分析;
2.基于流式细胞术的淋巴细胞亚群分析,具体包括T, B, NK, Mono等亚群的占比和绝对数量分析; Treg 亚群分析;T cell EM,CM等亚群分析;
3.基于流式细胞术的细胞增殖分析,包括Ki67+占比分析和EdU+细胞阳性率分析;
4.基于流式细胞术的受体占位率分析;
5.基于流式细胞术的受体表达量分析;
6.基于MSD,ELISA,Luminex和CBA的细胞因子分析;
7.基于ELISPOT的T细胞,B细胞激活分析。
参考文献
1.Cibrián, Danay, and Francisco Sánchez‐Madrid. "CD69: from activation marker to metabolic gatekeeper." European journal of immunology 47.6 (2017): 946-953.
2.Motamedi, Melika, Lai Xu, and Shokrollah Elahi. "Correlation of transferrin receptor (CD71) with Ki67 expression on stimulated human and mouse T cells: The kinetics of expression of T cell activation markers." Journal of immunological methods 437 (2016): 43-52.
3.Caruso, Arnoldo, et al. "Flow cytometric analysis of activation markers on stimulated T cells and their correlation with cell proliferation." Cytometry: The Journal of the International Society for Analytical Cytology 27.1 (1997): 71-76.
4.Starska, Katarzyna, et al. "Prognostic value of the immunological phenomena and relationship with clinicopathological characteristics of the tumor—the expression of the early CD69+, CD71+ and the late CD25+, CD26+, HLA/DR+ activation markers on T CD4+ and CD8+ lymphocytes in squamous cell laryngeal carcinoma. Part II." Folia Histochemica et Cytobiologica 49.4 (2011): 593-603.
5.Starska, Katarzyna, et al. "The role of tumor cells in the modification of T lymphocytes activity—the expression of the early CD69+, CD71+ and the late CD25+, CD26+, HLA/DR+ activation markers on T CD4+ and CD8+ cells in squamous cell laryngeal carcinoma. Part I." Folia Histochemica et Cytobiologica 49.4 (2011): 579-592.