



前言
酶联免疫斑点技术(Enzyme Linked Immunospot Assay,简称ELISPOT)是细胞免疫学研究中最为敏感的检测方法,可以在单细胞水平对抗体分泌细胞(如B细胞)及细胞因子分泌细胞(如T细胞)进行检测,该方法有极高的灵敏度,可达20-25斑点/100万细胞,并且该方法能够对抗原刺激后的活细胞进行功能性检测,是疫苗领域药效评估的关键检测方法。随着生物药领域向肿瘤免疫深入迈进,ELISPOT技术也逐步成为基因治疗,细胞治疗(CART, TCRT),抗体/双特异抗体药物的生物分析领域的主流技术。
酶联免疫斑点技术的基本流程
酶联免疫斑点技术的基本原理是通过免疫细胞和对应的刺激物进行共培养,然后使用类似于ELISA双抗夹心法对有刺激反应的免疫细胞进行检测。由于免疫细胞激活机理的复杂性性,根据免疫细胞的来源选择,刺激物的类型,刺激方式的不同会衍生出不同应用方向,不同灵敏度的ELISPOT检测方法,其简要的流程如图1所示
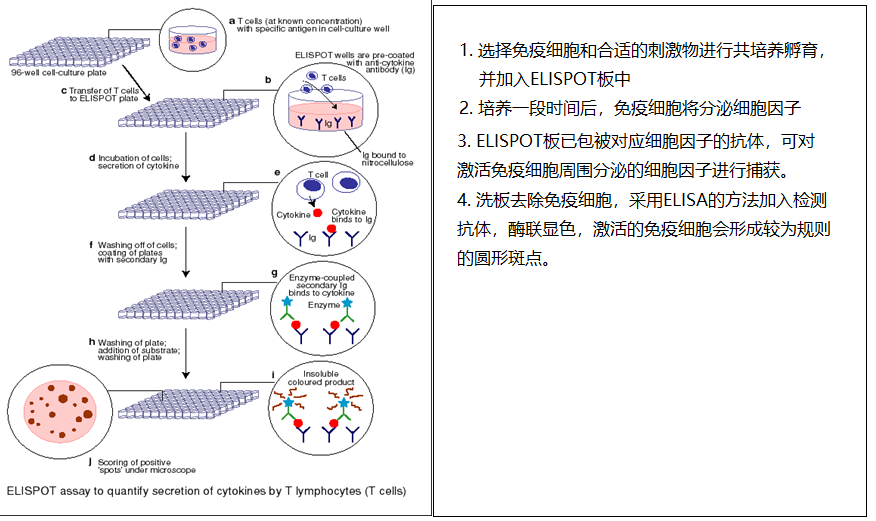
图1:ELISPOT技术基本操作流程
ELISPOT技术用于疫苗药效学评估
目前ELISPOT技术最为广泛应用的领域是用于感染性疫苗的临床阶段的药效学评估,通常采用感染性病毒受体片段多肽库(如新冠S蛋白多肽库)作为刺激物,通常取临床受试者的免疫细胞进行共孵育培养,通常为T细胞,有时会将T细胞进行细分为CD4+T细胞和CD8+T细胞,示例如下图2康希诺生物Ad5载体重组蛋白新冠疫苗和辉瑞/BioNTech mRNA新冠疫苗使用ELISPOT技术用于疫苗的细胞免疫药效学评估。
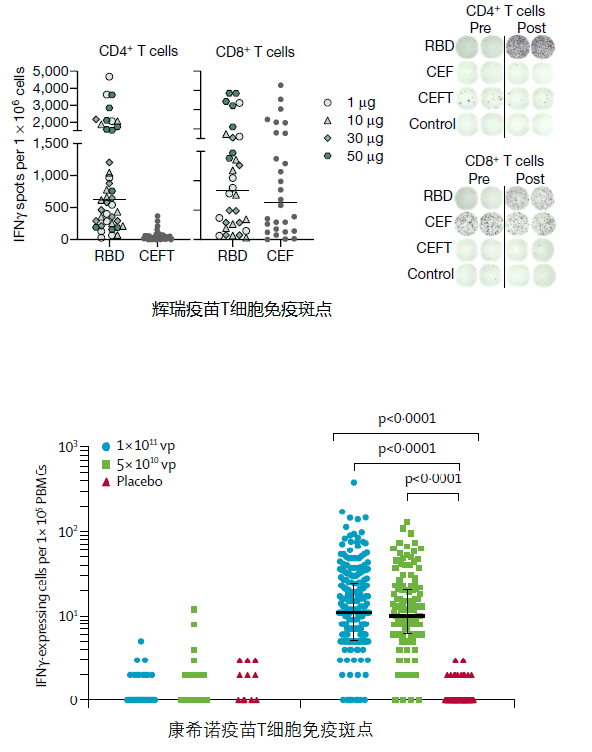
图2:ELISPOT技术用于感染性疫苗的药效学评估
ELISPOT技术也是肿瘤疫苗进行临床阶段的药效学评估的重要检测和筛选技术。相对于感染性疫苗,肿瘤疫苗引起人体的免疫反应较弱,同时由于肿瘤的异质性,肿瘤疫苗需要表达多样化的肿瘤相关抗原或者新生抗原来使患者获得对于肿瘤的免疫能力。ELISPOT技术基于其高灵敏性是肿瘤疫苗进行早期药效学评估,判断疫苗中各个相关抗原或者新生抗原是否对人体有效,支持后续的临床决策非常关键的检测技术,如图3某DC肿瘤疫苗在单一肿瘤相关抗原多肽刺激下的T细胞免疫反应。
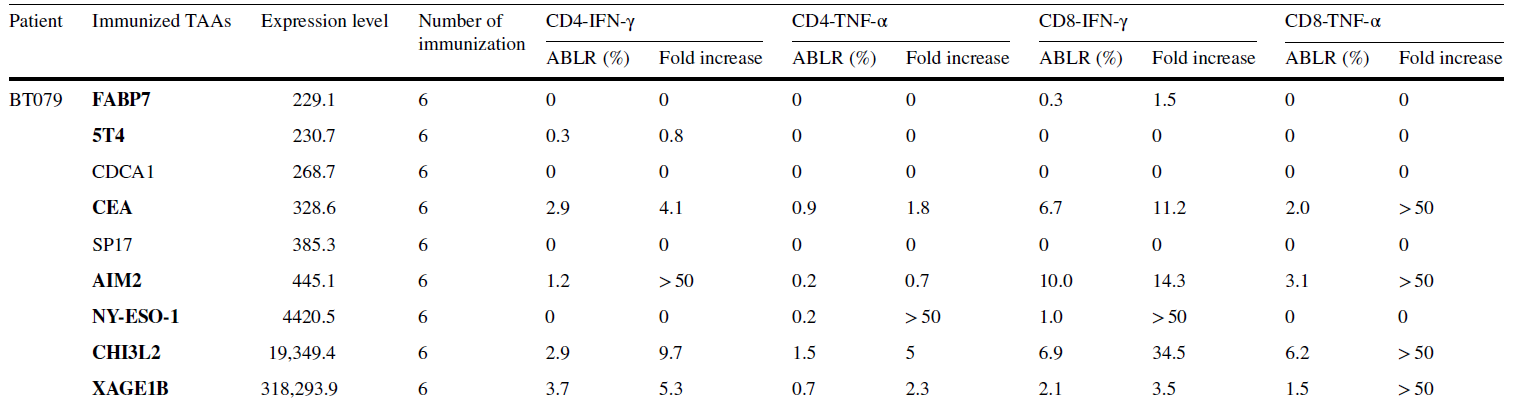
图3:ELISPOT技术用于肿瘤疫苗肿瘤相关抗原的评估
在CDE发布的《新型冠状病毒预防用mRNA疫苗药学研究》指导原则中如图4同时也强调了mRNA疫苗的质量研究需要进行体内效力试验,推荐使用ELISPOT技术检测评价mRNA疫苗的细胞免疫反应。

图4:mRNA疫苗药学生物活性研究内容
ELISPOT技术用于CART的免疫原性评估
CART细胞免疫疗法是将来自人体的T细胞经过基因编辑,安装上能够识别肿瘤细胞的特异性蛋白受体,然后扩增后回输回人体。由于基因编辑后的CART细胞能够持续在人体扩增,并且特异性的识别肿瘤细胞,起到杀伤病人体内肿瘤细胞的作用,CART在人体的持续扩增和存续是CART细胞免疫疗法取得杰出疗效的关键,而人体针对CART细胞的免疫原性是影响CART细胞扩增存续的关键因素。目前上市靶向CD19的几款CART产品其特异性蛋白受体均是鼠源的FCM63 scFV,有较强的免疫原性风险。关于文献披露的FCM63 scFV是否存在免疫原性,每个上市CART产品测定的ADA发生率差异较大,但整体的结论是ADA不影响药效。
目前上市的CART其适应症均在血液肿瘤领域,在实体瘤领域鲜有突破,对此Wagner,2021在Immunogenicity of CAR T cells in cancer therapy的综上中提到了一个可能的原因,由于现有的CART产品主要是靶向清除B细胞,同时在治疗前均进行了清除淋巴细胞的处理,
CART产品注射后由于人体免疫细胞的缺失不会产生对CART细胞的免疫原性,短时间不会影响到CART的疗效。随着人体免疫系统的恢复,即使人体潜在存在针对CART的免疫原性,由于CART细胞会持续杀伤B细胞,中短期不会影响到CART的疗效,但是针对CART的免疫原性T细胞会最终影响到CART的存续,影响到CART产品的长期药效。同时文献记载针对B细胞血液瘤的CART产品再次回输不会取得很好的疗效也是潜在CART免疫原性会影响到药效的佐证。而在实体瘤领域,CART产品注射后人体如果产生了免疫原性,人体的B细胞会分泌针对CART的中和抗体,阻断CART细胞杀伤肿瘤细胞,人体的T细胞会攻击CART细胞,影响到CART细胞的大量扩增和存续,进而影响到CART产品针对实体瘤的疗效。总结来说,免疫原性是影响到CART疗效,特别是实体瘤疗效,以及是否能再次回输的关键因素之一,如图5。

图5:免疫原性对血液肿瘤和实体瘤CART疗效的影响
Brudno在2020年发表过对比试验,使用ELISSOT技术检测CART产品的免疫原性,评估携带FCM63的CART和全人anti-CD19的CART产品对于CART产品的存续的影响,如下图,总结来说全人抗CD19 CART人血液中CART一个月后,有细胞免疫原性的个体和无细胞免疫原性的个体分组,体液循环中CART的数量没有显著差异。FCM63 CART人血液中CART一个月后,有细胞免疫原性的个体和无细胞免疫原性的个体分组,体液循环中CART的数量虽然差异不够显著,但是有变小的趋势,如图6。
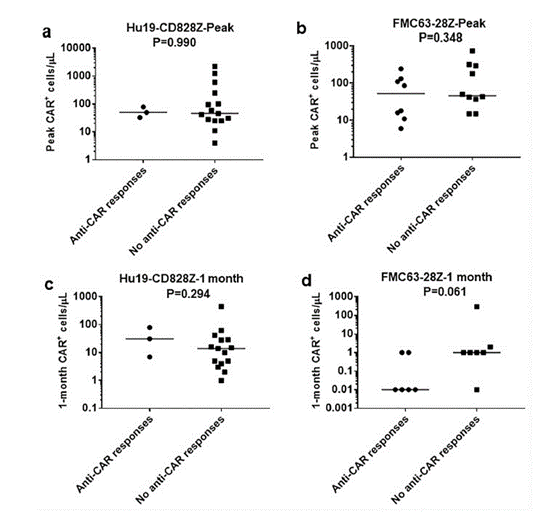
图6:FCM63和人源CD19抗体CART免疫原性和CART细胞存续的相关性
同种异体CART(通用型CART) 是CART药物降低成本,提高患者可及性,满足未被充分满足临床需求的关键,改造后的同种异体CART是否具有能够达到预期的效果,使用健康个体的PBMC作为免疫细胞,辐照后的同种异体CART 作为刺激物,使用高灵敏度的ELISPOT技术进行评估是相对较优的评估模式,见图7。

图7:ELISPOT技术用于通用型CART的免疫排异评估
ELISPOT试验用于AAV基因治疗药物的细胞免疫原性评估
2019年FDA批准诺华公司研发的Zolgensma®(Onasemnogene abeparvovec,AVXS-101)在美国上市,用于治疗2岁以下脊髓性肌萎缩症(spinal muscular atrophy,SMA)的儿童患者。2022年8月STAT和Endpoints News先后报道,两名儿童在接受Zolgensma治疗后死亡,原因查明,罪魁祸首是急性肝功能衰竭。急性肝功能发生的根本原因是Zolgensma的病毒载体为AAV9对肝脏均具有较强的亲嗜性,如下图8所示该AAV9基因药物注射到人体后会感染人的肝细胞,其衣壳蛋白会被肝细胞水解,形成HLAI病毒多肽复合物。人体的CD8+毒性T细胞会识别HLAI病毒多肽复合物,从而攻击人体的肝细胞,引起级联的炎症反应,造成患者发生急性肝功能衰竭。通过ELISPOT的技术评估病毒载体在人体是否能引起T细胞免疫反应是临床评估基因治疗安全性重要的指标参数。
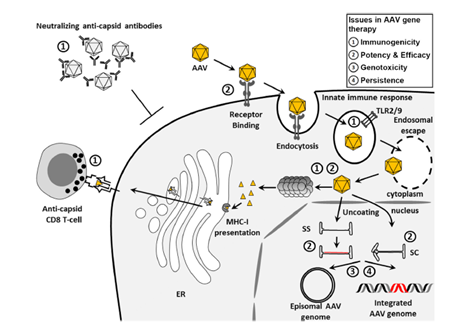
图8:AAV基因治疗药物介导的细胞免疫原性引起的肝脏毒性机理
基于AAV基因治疗一次治疗,长期有效的特征,AAV基因治疗产品的细胞免疫原性将是影响其安全性,同时也是影响其有效性最为核心的考察项,如图9所示,在一款凝血因子的AAV2基因治疗药物,其疗效受限于机体逐步增强的针对于病毒载体的细胞免疫原性。
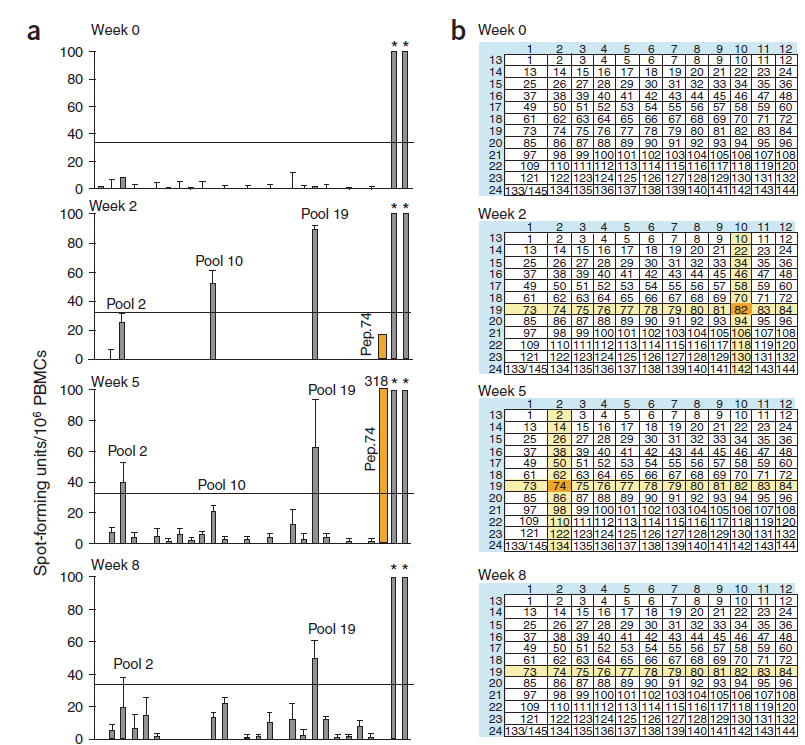
图9:使用ELISPOT技术检测因治疗药物介导的细胞免疫原性
熙宁酶联免疫斑点技术(ELISPOT)技术经验
酶联免疫斑点技术(ELISPOT)作为最为灵敏的检测技术,同时也是最容易受到干扰的检测技术,其方法的稳定性,样品稳定性和数据解读是关键。
ELISPOT的检测结果除了受样品的功能活性的影响,同时受到样品的活性的影响和个体免疫学遗传背景的影响,在验证和检测过程中需要设置严格的对照组,基于分组需要有完善的方法学验证方案和验证参数用于数据的解读.如图10

图10. ELISPOT试验分组设置以及验证参数
PBMC的活性将极大的受到全血采集后的保存时间的影响,通常情况下全血采集后8小时内进行PBMC分离,PBMC的活性才能有效的保留,极大了限制了ELISPOT的应用。熙宁生物自主开发的全血稳定剂配方和全血保存/分离条件的摸索积累,可将全血保存时间延长至30小时再分离PBMC,ELISPOT结果无显著的变化,同时在48小时进行分离PBMC,ELISPOT结果能够大部分保留,如图11。
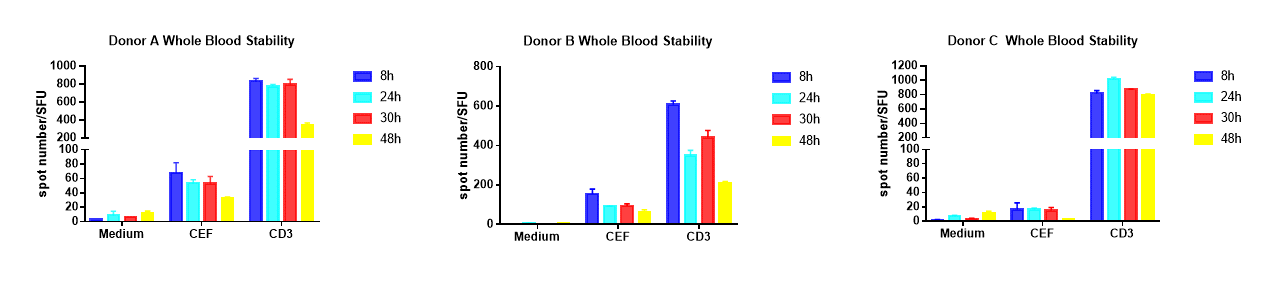
图11.熙宁生物基于全血稳定剂分离PBMC的全血稳定性检测结果
相比文献记载,不经过全血稳定剂处理的全血在放置24小时和48小时后,得到的斑点数目有80%以上的丢失如图12,极大了延长了全血运输稳定性,增加了ELISPOT样品分析的可及性。
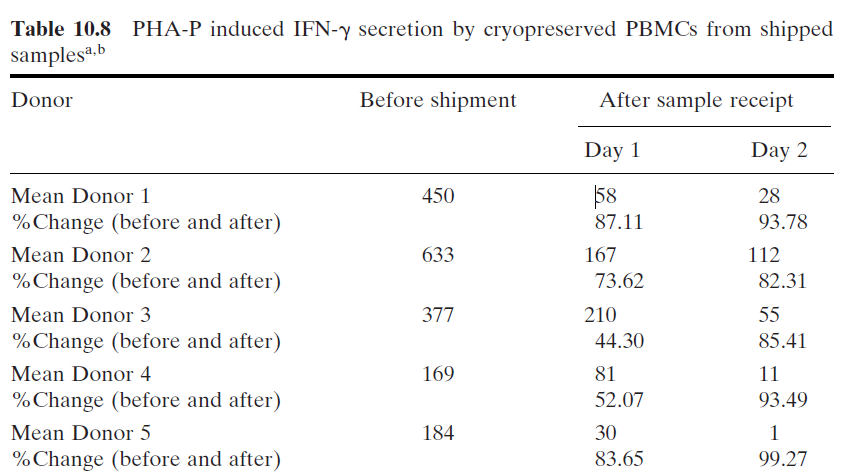
图12.未经全血稳定剂分离PBMC的全血稳定性检测结果
熙宁生物提供临床前和临床阶段细胞治疗、基因治疗和疫苗类药物研发的细胞免疫原性检测服务,欢迎咨询。
参考资料:
1. CDE 新型冠状病毒预防用mRNA疫苗药学研究
2. Fcz A , Xhg B , Yhl C , et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial[J]. 2020.
3. Sahin U , Muik A , Derhovanessian E , et al. Publisher Correction: COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responses[J]. Nature, 2021:1-1.
4. Wagner DL, Fritsche E,etc. Immunogenicity of CAR T cells in cancer therapy. Nat Rev Clin Oncol. 2021 Jun;18(6):379-393.
5. Brudno JN, Lam N,etc. Safety and feasibility of anti-CD19 CAR T cells with fully human binding domains in patients with B-cell lymphoma. Nat Med. 2020 Feb;26(2):270-280.
6. Colella P, Ronzitti G, Mingozzi F. Emerging Issues in AAV-Mediated In Vivo Gene Therapy. Mol Ther Methods Clin Dev. 2017 Dec 1;8:87-104.
7. Manno CS, Pierce GF, etc. Successful transduction of liver in hemophilia by AAV-Factor IX and limitations imposed by the host immune response. Nat Med. 2006 Mar;12(3):342-7.
8. Validation of Cell-Based Assays in the GLP Setting-VALIDATION OF THE IFN-γ ELISPOT ASSAY.