



2022年11月22日,美国FDA宣布批准uniQure与CSL Behring合作研发的AAV基因疗法药物Hemgenix(AMT-061,CSL222)上市,这是FDA批准的首款治疗成人患者B型血友病的基因疗法药物,同时也是迄今为止第六款上市的AAV基因疗法药物。Hemgenix高达350 万美元的售价也再次刷新了基因疗法药物的价格,成为全球单次治疗最昂贵的药物。
重组腺相关病毒(recombination adeno-associated virus,rAAV)是一类经基因工程优化后的单链线性DNA 缺陷型病毒,因其具有高效的转导能力、较弱的免疫原性、非整合性以及能特异性感染各组织器官、在宿主内能稳定表达等特点,已被作为一种安全有效的病毒载体用于基因治疗的临床试验,并获得了一定的成功。
截至2022 年11 月,全球已有6 款AAV基因治疗药物获批上市。熙宁生物通过对全球范围内获批上市的AAV药物和国内IND申请获批的AAV基因疗法进行汇总和分析,包括药物分类、药物名称、适应证、批准日期、批准国家、研发公司等,期待为国内外AAV药物的研发和临床提供参考。
已上市AAV药物
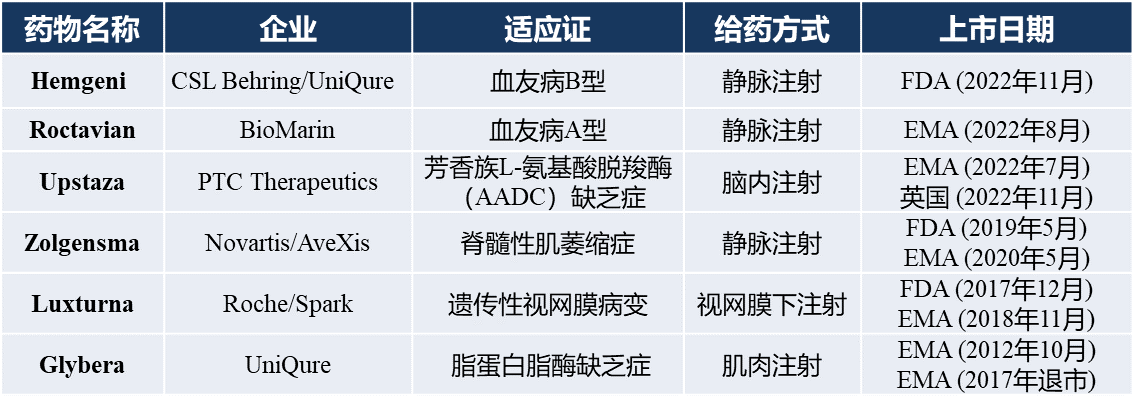 图1.已上市的6款AAV基因药物(熙宁生物整理)
图1.已上市的6款AAV基因药物(熙宁生物整理)
AAV药物发展历程
迄今为止,已有6款AAV基因疗法获批上市,详细介绍如下:
2012 年10月,EMA批准Glybera (Alipogene Tiparvovec) 用于治疗胰腺炎反复发作导致的脂蛋白脂肪酶缺乏症(LPLD)。Glybera由UniQure公司开发,以腺相关病毒1 型 (AAV1) 作为载体将治疗基因LPL转导入肌细胞,从而使相应的细胞能够产生一定数量的脂蛋白脂酶,起到缓解疾病的作用。
研究表明,该疗法一次给药长期(药效可持续多年)有效。Glybera 成为首个获批上市的AAV基因治疗药物,同时也是首个获批用于治疗 LPLD 的药物,值得注意的是,该药物于2017年退市。
2017年12月,FDA批准Luxturna(Voretigene Neparvovec-rzyl)用于人视网膜色素上皮特异性蛋白65 kDa (RPE65) 基因突变相关视网膜变性的治疗。Luxturna由Spark Therapeutics公司开发,利用AAV2载体携带人RPE65的cDNA片段,通过视网膜下注射的方式将药物递送至患者的视网膜细胞内,表达视力所必需的全反式视黄基酯异构酶,可在几个月内恢复患者视力,从而有效地治疗双等位基因RPE65 突变相关的视网膜变性患者。
2019年5月,FDA批准Zolgensma(Onasemnogene Abeparvovecxioi)上市,用于治疗2岁以下脊髓性肌萎缩症(Spinal Muscular Atrophy, SMA)患者。Zolgensma由AveXis/Novartis公司开发,通过scAAV9载体经静脉注射将正常运动神经元存活基因1(SMN1)导入患者体内,产生正常的SMN1蛋白从而改善运动神经元等受累细胞的功能。
Zolgensma曾以212.5万美元的售价占据全球最贵药物,2021年销售额为13.51亿美元,2022年前9个月实现销售收入10.61亿美元。目前Zolgensma已在40多个国家获批,2022年1月,中国国家药监局药品审评中心(CDE)信息公开中心显示,诺华(Novartis)旗下治疗脊髓性肌萎缩(Spinal Muscular Atrophy, SMA)的AAV基因治疗药物Zolgensma(OAV101注射液)在中国递交的临床试验申请已获得临床试验默示许可,目前正在开展临床三期实验。
2022年7月,EMA批准Upstaza (Eladocagene Exuparvovec)上市,用于治疗18 个月及以上的芳香族 L-氨基酸脱羧酶 (AADC) 缺乏症患者。Upstaza由PTC Therapeutics公司研发,AADC缺乏症患者是由编码AADC酶的DDC基因突变,导致AADC酶功能缺失,从而致使体内左旋多巴(L-Dopa)和5-HTP的代谢出现紊乱,造成体内多巴胺和血清素缺乏,目前尚未有治愈AADC缺乏症的药物获得批准上市。
Upstaza以AAV2为载体将DDC基因直接递送到大脑中的壳核脑区,恢复患者AADC酶的表达,从而重塑患者体内多巴胺水平。Upstaza成为第一款通过脑内注射给药的基因治疗药物,同时也是第一款获得上市批准的用于治疗18个月以上芳香族L-氨基酸脱羧酶(AADC)缺乏症的AAV基因治疗药物,此外,通过AAV载体递送人类AADC的基因疗法还具备治疗帕金森病的可能。
2022年8月,Roctavian (Valoctocogene Roxaparvovec)获EMA批准上市,用于治疗无FVIII 因子抑制史且AAV5抗体阴性的严重血友病A成人患者。Roctavian由BioMarin Pharmaceutical公司开发,以AAV5为载体,使用人源肝特异性启动子HLP驱动B domain删除了的人凝血因子八(FVIII)的表达,使患者身体能够自行产生VIII因子,从而减少持续预防性治疗(静脉输注因子VIII)的需求。临床试验结果显示,单次输注后,受试者的年出血率(ABR)显著降低,重组凝血因子VIII(F8)蛋白制剂使用频率降低,或者体内血液中F8活性显著增加,安全性良好,没有受试者出现F8因子抑制、恶性肿瘤或血栓副作用,也没有报告与治疗相关的严重不良事件 (SAE)。
2022年11月,FDA批准uniQure与CSL Behring合作研发的AAV基因疗法药物Hemgenix(Etranacogene Dezaparvovec)上市。Hemgenix是一款基于AAV5载体的基因疗法,旨在使用AAV5载体递送表达凝血因子IX (FIX)基因变(FIX-Padua),这种变体比普通凝血因子IX的活性要强5-8倍,可以在更低的表达水平完成正常凝血功能。该疗法可将基因递送到肝脏,新合成的凝血因子IX可以促进凝血,减少出血事件的发生。这是FDA批准的首款治疗成人患者B型血友病的基因疗法,同时也是迄今为止第六款上市的AAV基因疗法。
此外, GS010(AAV2-ND4)、PF-06838435(AAV-Spark100-hFIX-Padua)、AGTC-501( AAV2tYF- RPGR)等在研药物也已进入临床后期阶段,值得持续关注。
3.中国AAV基因疗法临床进展
中国AAV基因疗法进展相对缓慢。截止2022年11月,国内有多款AAV基因治疗药物申请IND,针对适应症大部集中在眼科、神经和血液病领域,多数为单基因遗传病。
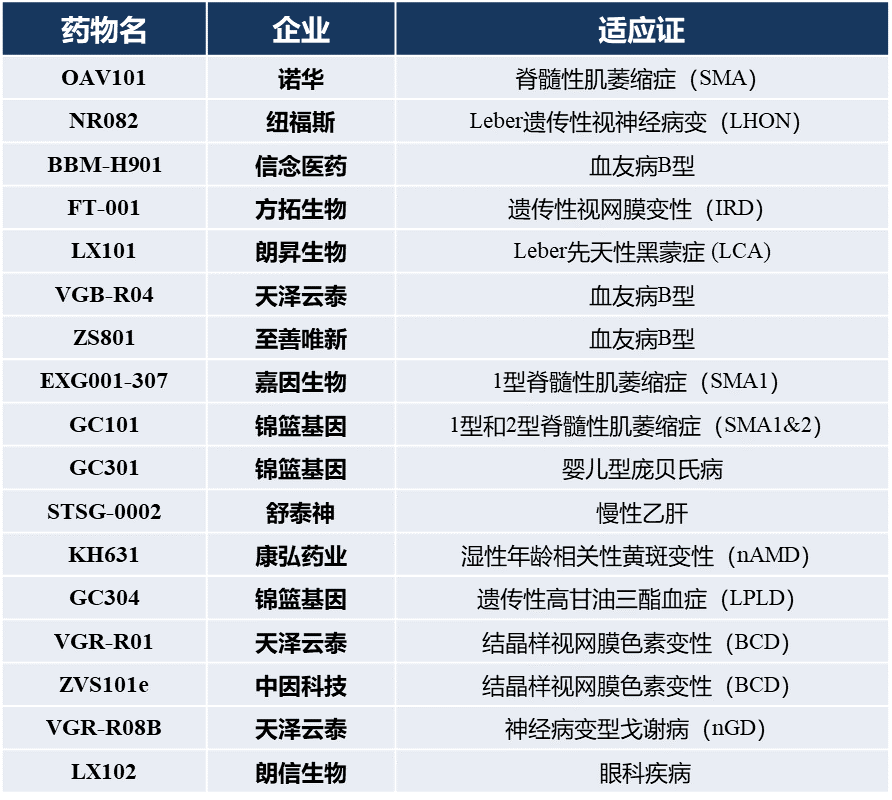
图2. 中国AAV基因药物临床进展汇总(从CDE官网整理)
4.AAV基因疗法最新研发进展
基因疗法治疗遗传性耳聋取得新突破,治疗先天性耳聋基因疗法(RRG-003)已启动研究者身份发起的临床试验研究(IIT),旨在探索RRG-003治疗OTOF突变耳聋的安全性、耐受性以及初步疗效。
RRG-003候选药物,是将AAV基因疗法应用于内耳,旨在根治恢复或改善OTOF突变耳聋患儿的听觉和言语功能,利用局部的微创给药将RRG-003递送到耳蜗内,从而补偿耳畸蛋白缺陷,达到恢复听力目的。这是国内开展的首个用于治疗耳聋的AAV基因疗法临床试验。
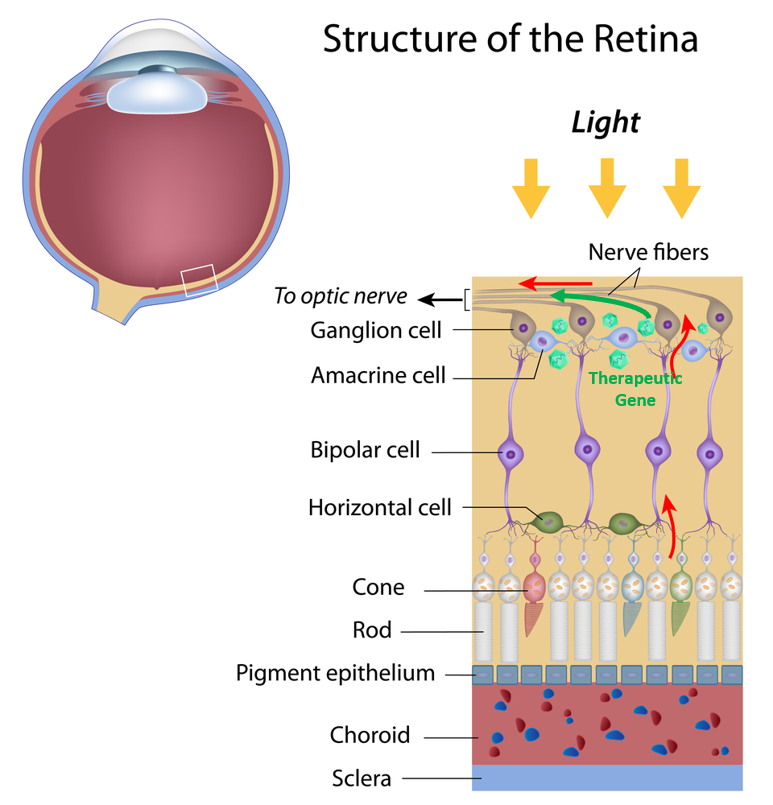
图3. 视网膜结构和视觉传导通路
在眼科疾病领域,光遗传学新型基因治疗策略有望使完全失明的患者重新恢复视力。当光线进入眼睛时,它被感光细胞捕捉,光感受器随后向其邻近的视神经节细胞发送电信号,视神经节细胞可以识别出运动等重要特征,随后它们将信号经由视神经将信息传递给大脑形成视觉。尽管色素性视网膜炎患者失去了视网膜感光细胞,但是眼睛内的视神经节细胞、双极细胞、水平细胞可长期存活,因此可利用将携带表达外源光敏蛋白的AAV通过眼内注射的方式传递给视神经节等靶细胞,通过视神经中的视蛋白将光信号直接转化为电信号传递给大脑,进而使患者恢复视力。
国内方面,一项由研究者发起的、评价视蛋白(Opsin)基因治疗晚期视网膜色素变性患者的安全性、耐受性及初步疗效的临床试验在2022年7月进行了注册(ChiCTR2200062174)。在晚期视网膜色素变性患者中,评估基因治疗药物(UGX-06)通过单次玻璃体腔注射(IVT)的安全性和耐受性,和评估初步疗效。国外方面,GenSight Biologics (GS030), Nanoscope Therapeutics (MCO-010),Bionic Sight,Vedere Bio等光遗传AAV基因疗法已获得FDA认可,治疗视网膜病已初步显示了其良好的疗效,期待这一疗法未来惠及更多患者。
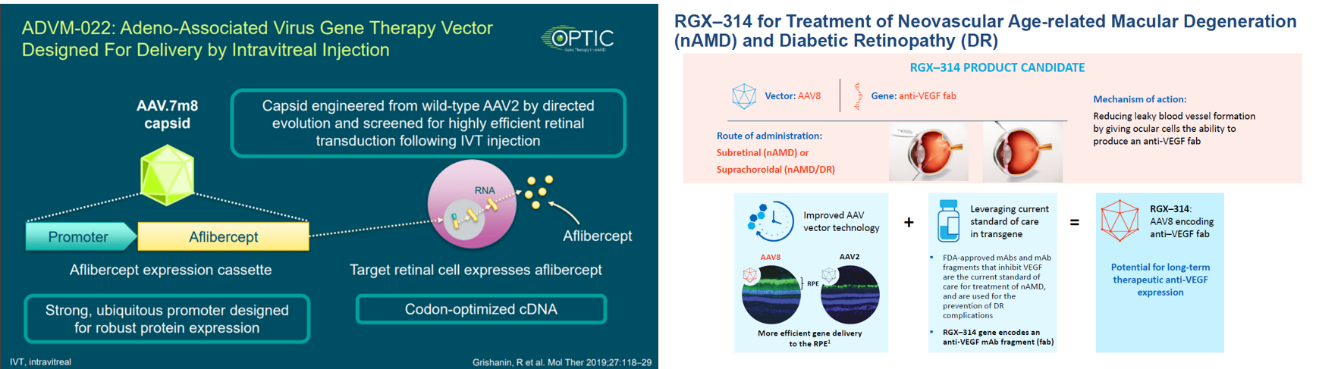
图4. 湿性年龄相关性黄斑变性(nAMD)基因治疗药物
从罕见病作为切入点,探索在常见病领域应用的可能性,惠及更多的患者才是基因治疗最重要的考量。血管内皮生长因子 ( VEGF) 已被证实在湿性年龄姓黄斑变性(nAMD)中起重要作用,如果说眼科疾病是基因疗法一个不错的切入口,那么nAMD将会是从罕见病向常见病拓展的重要突破口。康弘药业KH631是我国第一个获批进入临床、用于治疗新生血管性(湿性)年龄相关性黄斑变性(nAMD)的基因治疗产品。国外方面,Adverum Biotechnologies (ADVM-022)、Regenxbio (RGX-314)、4DMT (4D-150)等临床I、II期试验结果提示:单次治疗大幅降低了年化抗VEGF注射频率,受试患者在视力上均得到长期、持久的效果改善。
5.总结
以AAV为载体的基因治疗药物已为罕见病带来突破性的疗效。基因治疗正处迅速发展期,越来越多的基因治疗药物进入到临床试验阶段。相信在不久的将来,基因治疗会给更多的疾病带来颠覆的解决方案,给患者带来更多的用药选择。
6.熙宁生物基因治疗经验
熙宁生物是一家专业的符合国际GLP&GCP质量管理规范的生物分析实验室,为国内外医药公司提供临床和临床前生物分析(Bioanalysis,BA) 和伴随诊断(Companion Diagnostics,CDx) 产品开发服务。
熙宁生物搭建了满足基因治疗药物的临床检测需求和药物联用的基因检测平台,细胞/病毒检测平台,流式检测平台和免疫检测平台,通过qPCR/ddPCR技术,细胞中和抗体检测技术,流式检测技术,ELISA/MSD检测技术等齐备的技术互联,能够实现一个临床,一个生物分析实验室,一个技术项目团队,能够提供基因治疗产品临床生物分析的整体解决方案和技术服务能力,且具备丰富的行业经验。
7.参考文献
1.https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapy-treat-adults-hemophilia-b
2.https://www.cde.org.cn/
3.Adeno-Associated Virus (AAV) as a Vector for Gene Therapy
4.Current Clinical Applications of In Vivo Gene Therapy with AAVs.
5.Current landscape of clinical development and approval of advanced therapies.
6.Viral vector platforms within the gene therapy landscape.
7.The new landscape of retinal gene therapy.
8.Gene therapy for inherited retinal diseases: progress and possibilities.
9.Gene therapy for neovascular age-related macular degeneration: rationale, clinical trials and future directions.
10.uniQure、Adverum、Regenxbio等公司官网