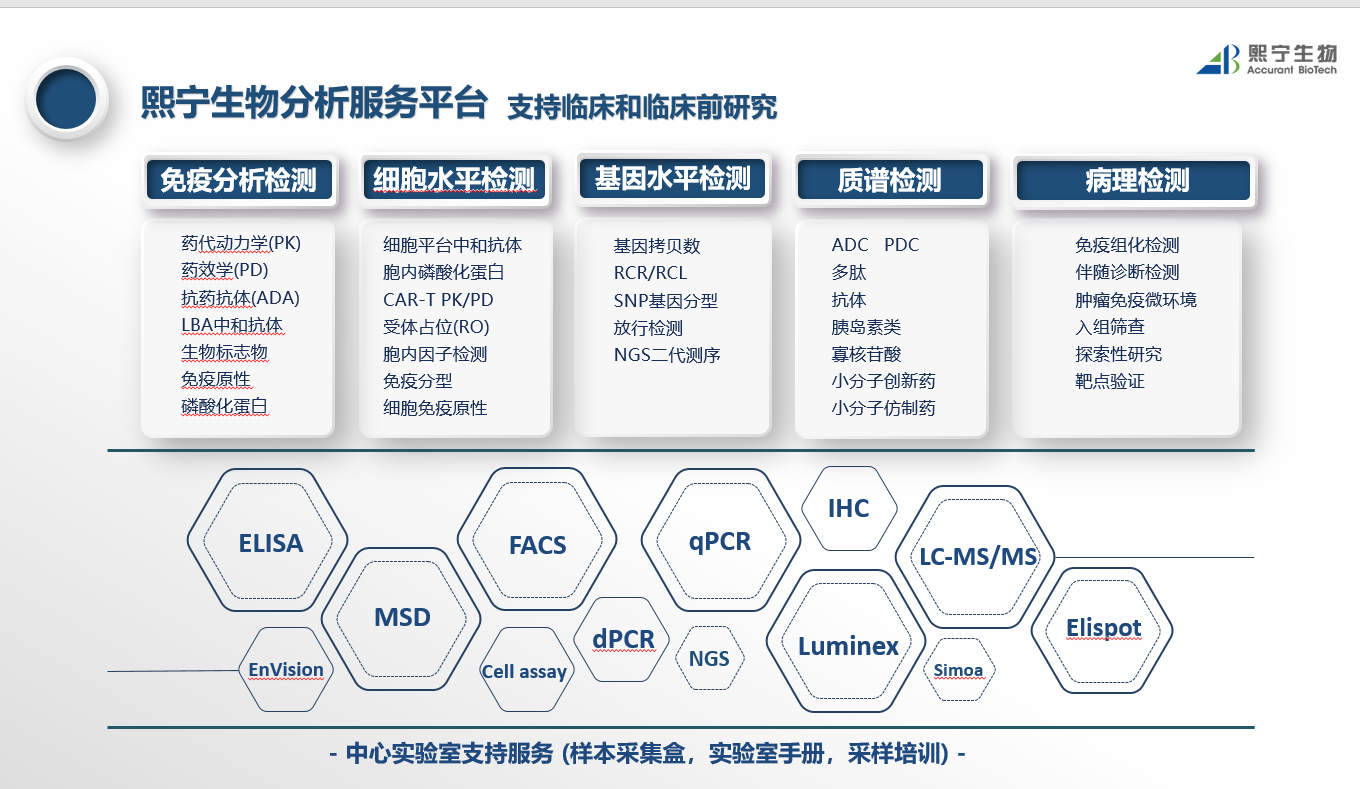
基因产品类型和临床分析技术解析
截止2022年11月份,全球至少有40款以上的基因治疗药物上市,包括离体基因治疗药物如CART产品倍诺达,慢病毒体外基因修饰造血干细胞产品Zynteglod等,也包括体内基因治疗药物如溶瘤病毒产品Imlygic,治疗SMA的反义寡核苷酸药物Spinraza,治疗双拷贝RPE65基因突变所致视力丧失的AAV2载体药物Luxturna,用于新冠病毒预防的mRNA疫苗BNT162b2和mRNA-1273等。
从药物的作用机理和生产工艺进行分类,基因治疗如下图1,可分为离体基因治疗药物和体内基因治疗药物。离体基因治疗药物通常需经历人体取出细胞,细胞在体外基因改造后再回输到人体的过程。体内基因治疗药物通常使用载体将目的基因序列直接导入人体细胞中,发挥基因表达调节,基因替代以及药物递送表达等药效学作用。
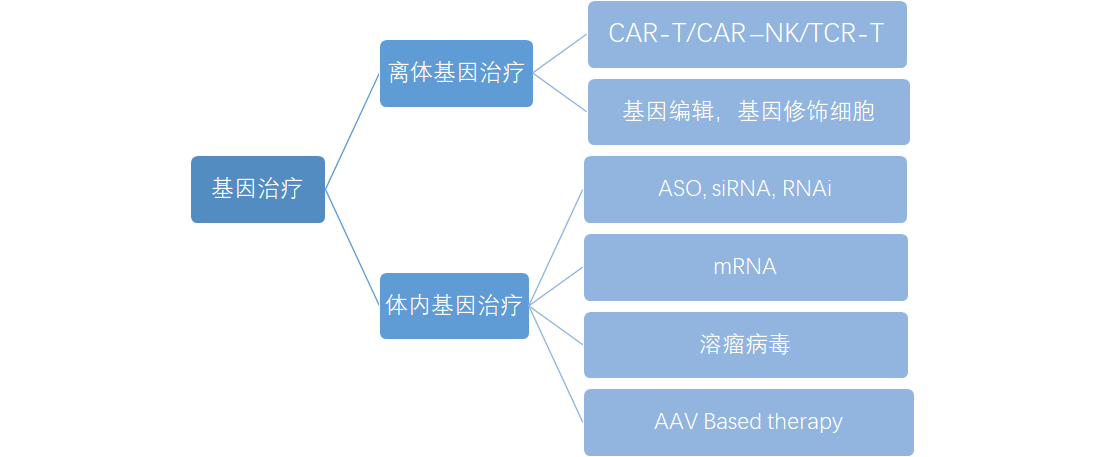
图1:基因治疗产品类别
基因治疗药物相对于传统抗体药物,小分子化药,有更为复杂的结构,工艺和作用机理,这也为临床生物分析带来了极大的挑战。如下图2,传统大分子药物评估需进行体内试验通常需要评估药物在体内的安全性和有效性,由于大分子药物在人血液中的即时浓度和人体对药物的免疫反应是影响药物在体内的安全性和有效性较为关键的因素,大分子药物的PK检测和免疫原性检测也是重要的分析检测项。类比大分子药物的体内评估,基因治疗药物通常也需要进行有效性和安全性评估。基于基因治疗药物的分子量极大,以及非常复杂的组成,基因治疗药物的PK检测和免疫原性检测内容会更加多样,同时面临多方面的挑战。
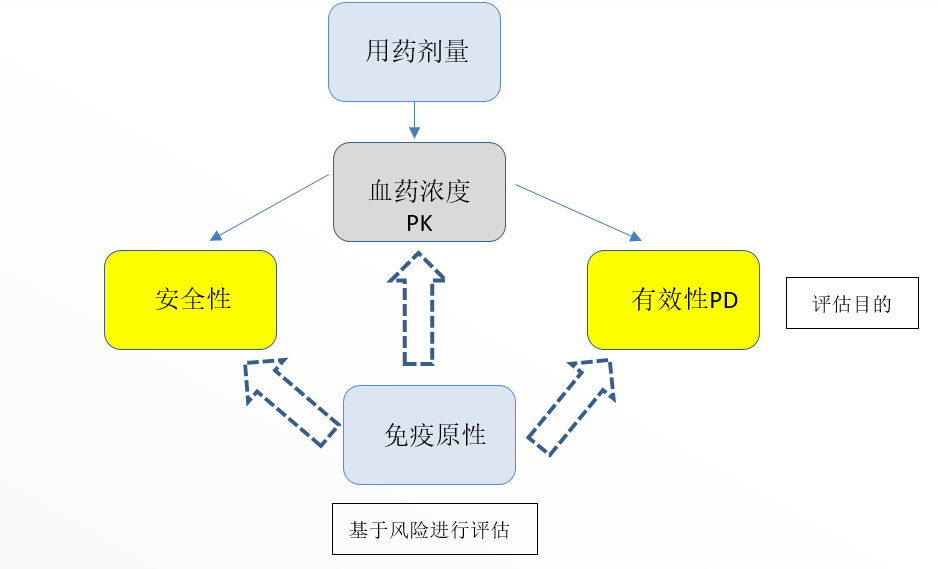
图2:临床研究生物分析目的
根据《基因治疗产品非临床研究与评价技术指导原则》,笔者列举了体内基因治疗产品需要进行了临床前和临床生物分析内容如图3,体内基因治疗药物的类型多样,根据药物的特征和作用机理进行全部或者部分检测项的生物分析检测,其中免疫原性/免疫毒性/免疫反应检测是体内基因治疗产品必备也是最为通用的生物,笔者在此将从基因治疗产品的免疫原性评估角度,对不同基因治疗产品需要做的免疫原性评估内容和方法学难点进行解析。

图3:基因治疗产品生物分析检测内容
免疫原性对基因治疗药物的影响
基因治疗药物的免疫原性评估的内容和深入程度度需要基于多方面的考量,对除了疫苗以外的基因治疗产品来说,如图4所示,大体是基于风险的评估,给药途径/方案,患者/适应症,载体生物学特征,表达产物特性,导入基因特性等多维度进行评估。基因治疗产品进入人体发生免疫原性的概率和发生免疫原性后造成后果的严重程度,是基因治疗产品进行免疫原性评估的两个重要考量点。免疫原性对安全性和有效性的影响也会直接影响到免疫原性评估的内容,程序以及分析方法的设计。
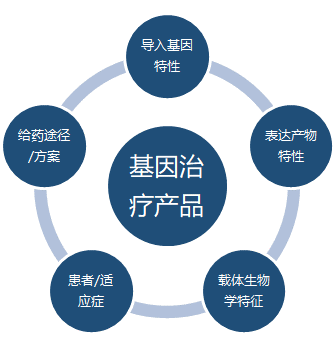
图4:基因治疗产品的风险评估要素
风险评估案例1-病毒载体的体液免疫原性
同为病毒载体的基因治疗药物溶瘤病毒和AAV Based药物,病毒载体的体液免疫原性对两种类型的基因治疗药物安全性和有效性的影响并不一样。溶瘤病毒通常为局部注射,通过直接裂解肿瘤和激发人体的免疫系统协同发挥药理学作用,机体产生对于溶瘤病毒的病毒载体的体液免疫可以限制病毒载体在人体中的扩散,某种意义来说是安全性指标。AAV Based药物需要通过AAV载体递送到人的细胞中,长期表达某些蛋白来发挥药效学作用,机体对AAV载体预存的体液免疫会影响AAV载体进入人体细胞内,从而影响到AAV对人体细胞的感染效果,进行影响到药物有效性性。基于此风险评估,在药物研发过程中,溶瘤病毒通常只监控病人用药后体液免疫原性,AAV based药物通常需要在入组筛查时进行体液免疫原性检测筛查,低于某一阈值的病人才会进行用药。
风险评估案例2-基因治疗表达产物的细胞免疫原性
mRNA病毒疫苗,mRNA肿瘤疫苗和AAV based药物均是通过人机体细胞表达蛋白或者多肽,进而发挥药效学作用。对于mRNA病毒疫苗,mRNA肿瘤疫苗来说,表达产物的细胞免疫原性是疫苗发挥药效学作用的重要指标,但是对于AAV based药物表达产物如果产生细胞免疫原性将会影响到药效,同时也会影响到安全性,是有效性和安全性的重要考察指标。mRNA病毒疫苗表达的非人源蛋白,T细胞反应较为激烈,细胞免疫评估过程中使用多肽刺激就能够满足检测的灵敏度需求;mRNA肿瘤疫苗表达的人源突变蛋白/突变多肽, T细胞反应较为温和,对于细胞免疫原性评估,使用多肽刺激进行评估方法的灵敏度有达不到需求的风险,可能需要使用抗原呈递APC刺激培养进行评估。AAV based药物的表达产物通常为人源蛋白,发生细胞免疫原性的概率较小,但是一旦免疫原性,对于安全性的影响将会极其严重,使用多肽进行评估监控细胞免疫原性是必不可少的。
通常情况下在临床早期均需要对基因治疗药物进行一些炎症细胞因子检测,表征基因治疗药物先天免疫对安全性的影响。对于体液免疫和细胞免疫,基于安全性和有效性的考量,如图5所示,不同基因治疗药物需要进行的免疫原性考察项以及对药物安全性和有效性的影响。
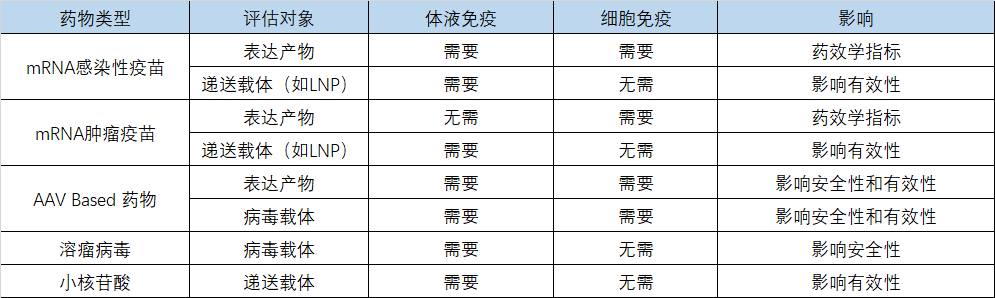
图5:不同类别基因治疗产品的免疫原性评估内容
总结讨论
对于不同类型的基质治疗产品需基于药物类型,免疫原性对药物有效性和安全性的影响进行风险评估,制定合适的免疫原性分析策略。熙宁生物基于在临床生物分析的资深经历可对不同类型的新兴基因治疗产品建立符合临床研发需求的免疫原性分析策略。
体液免疫原性检测和细胞免疫原性检测是基因治疗产品免疫原性评估的两个重要内容。熙宁生物基于基因治疗临床免疫原性评估实践将会陆续推出系列文章,对基因治疗药物中和抗体检测的难点和要点,细胞免疫原性评估的难点要点进行系统论述,欢迎持续关注。
熙宁生物基于对基因治疗产品特征的充分了解, 丰富的临床样品分析实践,技术过硬,质量可靠的价值观,全面的临床生物分析技术平台,提供临床前,IIT和临床阶段基因治疗药物全流程,一体化的生物样品分析服务。欢迎交流咨询。