补体系统是天然免疫的重要部分,在病原体免疫监测和维持组织稳态中起着重要作用。补体系统识别免疫复合物、受损细胞或病原微生物的分子信号,继而触发蛋白水解级联反应。该级联反应由三条途径组成,分别称为经典途径(CP)、凝集素途径(LP)和替代途径(AP)。补体系统的过量激活或者失调可能导致一系列的疾病发生。
随着Alexion研发的首款C5补体抑制剂Sorilis以及后续长效的C5补体抑制剂Ultomiris的成功,Apellis研发的首款C3补体抑制剂Empavel上市,诺华的IptacopanPNH适应症成功上市,并且近期开拓IgA肾病适应症,补体系统的药物研发成为越来越热的赛道。本文将对目前补体系统药物研发的热门靶点和相关适应症进行盘点,并深入解析补体信号通路原理和分析方法,此外还会分享熙宁生物丨精翰生物在此信号通路全方位的药效评估和临床分析转化研究检测经验。
PART 01
补体抑制剂药物研发进展
针对补体系统的过量激活开发了大量的补体信号通路关键分子的抑制剂,目前靶向C5、C3、C1S、Factor B等的抑制剂走在前列并已成功上市,适应症主要集中在PNH、 aHUS、myasthenia gravis等领域;同时随着新药研发的进程,在一期二期临床阶段,靶向Factor D、MASP2补体系统的新型抑制剂也在快速推进,部分补体系统的药物研发见图1,补体药物研发正当时。
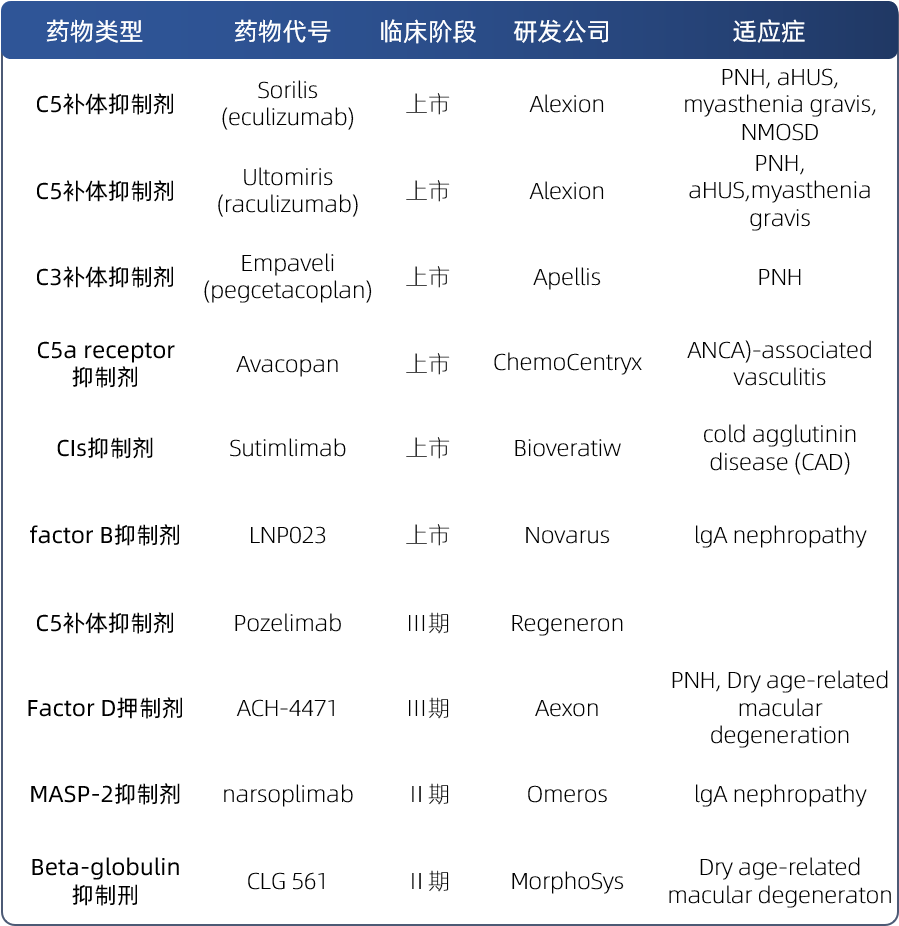
图1 补体抑制剂的研发进展
PART 02
补体抑制剂作用机理和药效学分析方法
如图2所示,补体系统的激活主要由三条路径组成:
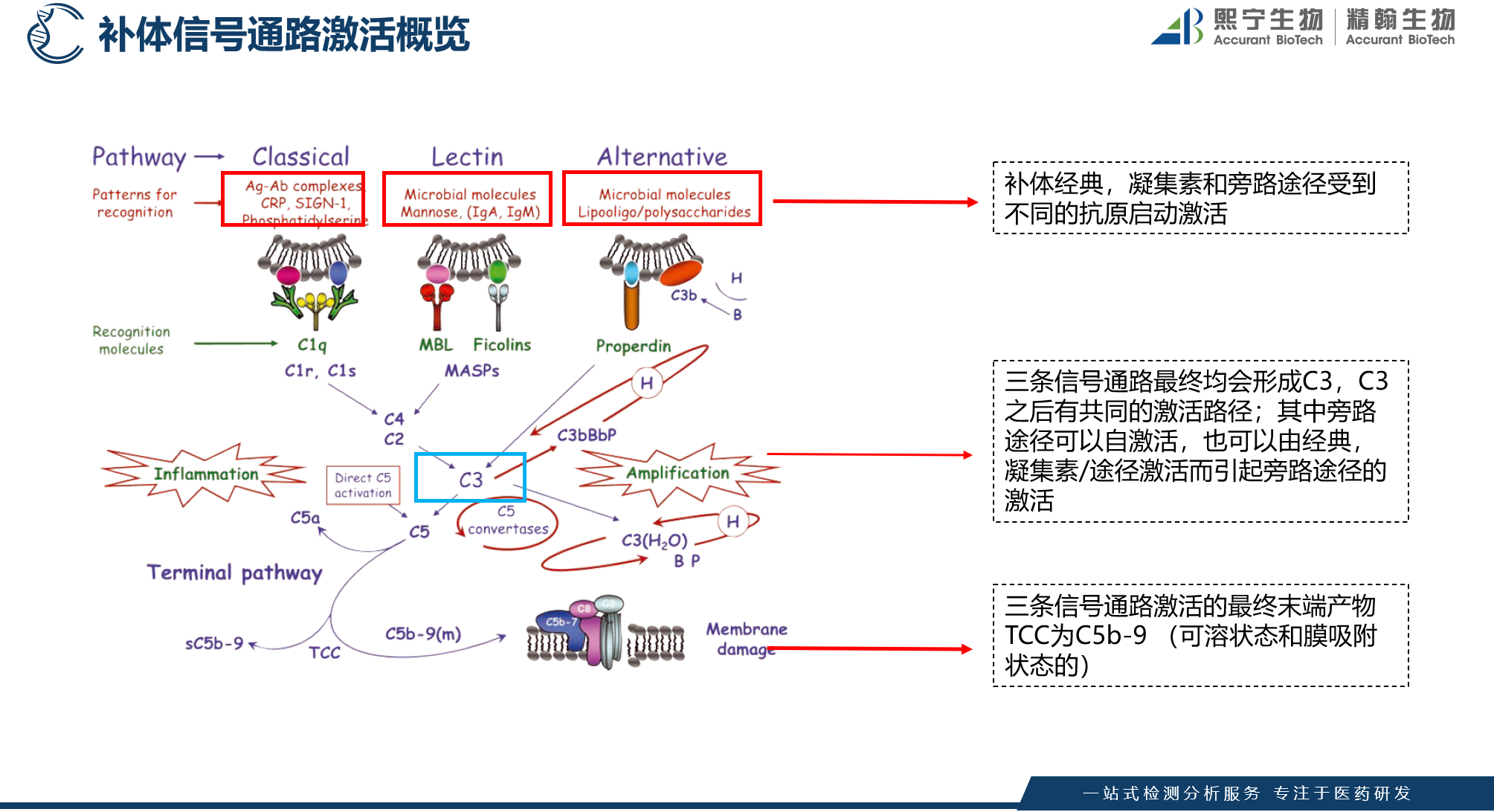
图2 补体系统的三条激活路径

经典途径(CP)
经典途径需要机体的抗体(通常为IgM,或者高度聚集的抗体)和特定的抗原形成复合物后启动,首先被补体系统中的识别单位:包括C1q、C1r、C1s识别;然后通过活化单位:包括C2、C3、C4形成级联反应,最后由膜攻击单位:包括C5、C6、C7、C8和C9,通过蛋白水解酶的作用形成C5b9复合物结合到细胞膜,使细胞膜损伤破碎。

凝集素途径(LP)
凝集素途径由机体的甘露聚糖结合凝集素(Mannan-binding Lectin,MBL)或纤维胶凝蛋白(Ficolin,FCN)直接识别多种病原微生物表面的甘露糖、N-乙酰甘露糖、N-乙酰葡萄糖氨、岩藻糖等为末端糖基的糖结构。MBL-MASP复合物与病原体表面糖结构结合,使MASP-1、MASP-2被独立地激活。活化的MASP2发挥其活性,裂解C4,所产生的C4b片段共价结合于病原体表面,通过与C2相互作用,使后者也被MASP2裂解,形成C3转化酶C4b2a,继之活化补体CP;活化的MASP1能直接裂解C3产生C3b,在fD和fP的作用下,形成C3转化酶C3bBb或C3bBbP,并产生C5转化酶C3bBb3b,激活补体LP, 最后由膜攻击单位:包括C5、C6、C7、C8和C9,通过蛋白水解酶的作用形成C5b9复合物结合到细胞膜,使细胞膜损伤破碎。

旁路途径 (AP)
旁路途径在正常生理情况下,机体的C3与B因子、D因子等相互作用,可缓慢的产生极少量的C3B和C3bBb(旁路途径的C3转化酶),但迅速受H因子和I因子的作用,不再能激活C3和后续的补体成分。
旁路途径的激活在于激活物质(例如细菌脂多糖、肽聚糖;病素感染细胞、肿瘤细胞,痢疾阿米巴原虫等)的出现。激活物质的存在为C3b或C3bBb提供不易受H因子置换Bb,不受Ⅰ因子灭活C3b的一种保护性微环境,使旁路激活途径从和缓进行的准备阶段过渡到正式激活的阶段。
当C3被激活物质激活时,其裂解产物C3b又可在B因子和D因子的参与作用下合成新的C3bBb。后者又进一步使C3裂解。由于血浆中有丰富的C3,又有足够的B因子和Mg2 ,因此这一过程一旦被触发。就可能激活的产生显著的扩大效应。有人称此为依赖C3Bb的正反馈途径,或称C3b的正反馈途径,激活效应将持续扩大, 最后由膜攻击单位:包括C5、C6、C7、C8和C9,通过蛋白水解酶的作用形成C5b9复合物结合到细胞膜,使细胞膜损伤破碎。
补体的三条信号通路可以由不同的物质启动激活,中间汇集到C3激活,形成C5、C6、C7、C8和C9级联反应,最终形成mC5b9复合物,使细胞膜损伤破碎。同时旁路途径除了被脂多糖等激活外,经典途径和凝集素途径的激活也会激活旁路途径,产生显著的扩大效应。三条补体激活信号通路既有区别,又深度关联,在药物研发实践过程中体外药效方法的特异性需要格外关注。
PART 03
CFB抑制剂和C3抑制剂的临床药效学分析方法解析
上市药物Empaveli的药物作用机理如图3:靶向补体蛋白C3,阻断C3进一步活化,从而抑制补体信号通路的激活。由于C3蛋白的活化是经典路径,凝集素路径和旁路途径共有,Empaveli可以同时抑制三条补体激活信号通路,跟三条信号通路相关的活性分析方法均能够表征其药效。
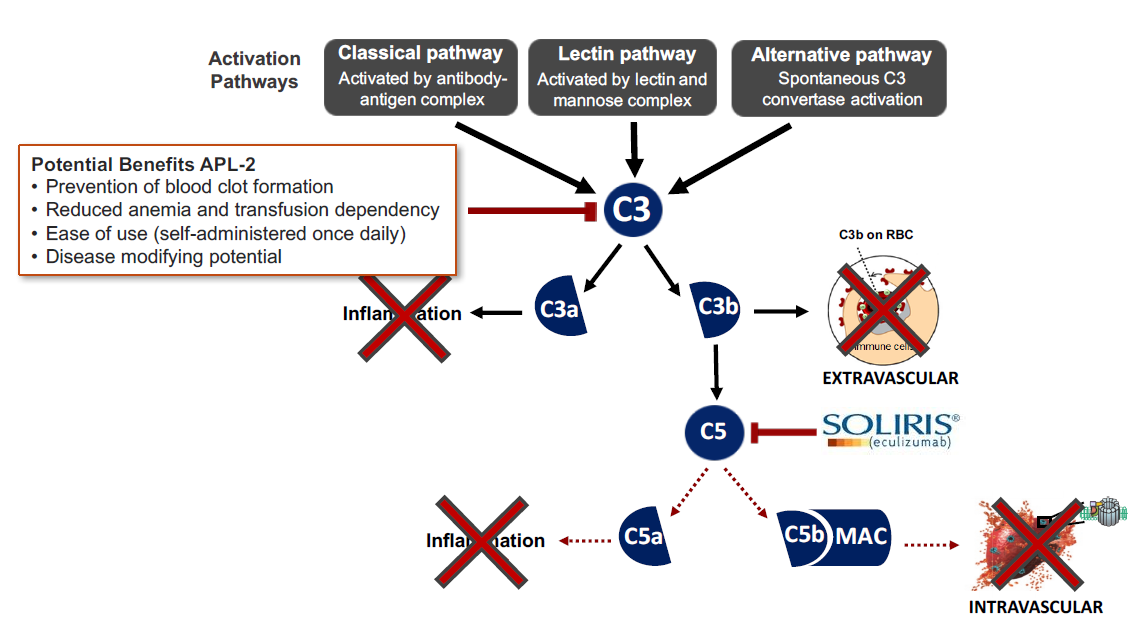
图3 Empaveli的药物作用机理
从Empaveli披露的文献信息,其药效学检测分析方法进行了C3活性,CH50和AP50的检测。

从Empaveli公布临床前前的药效学数据来看主要的依据是旁路途径的溶血试验抑制效果。
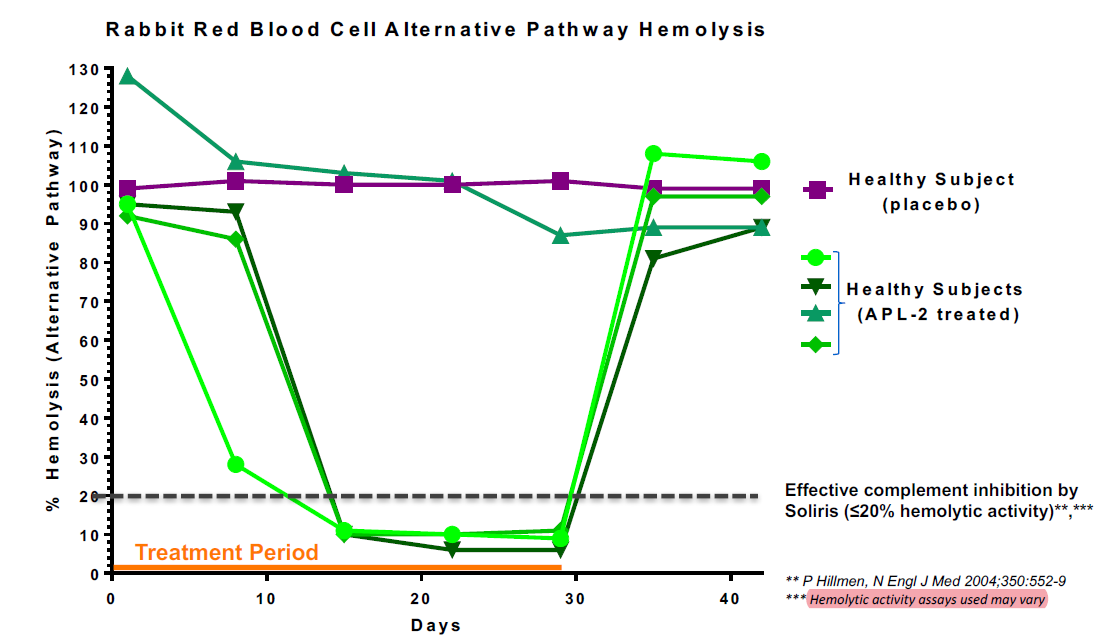
图4 Empaveli临床药效学数据
上市药物Iptacopan为CFB抑制剂,作用于补体旁路途径C3上游,其主要的药效学方法如下图5。
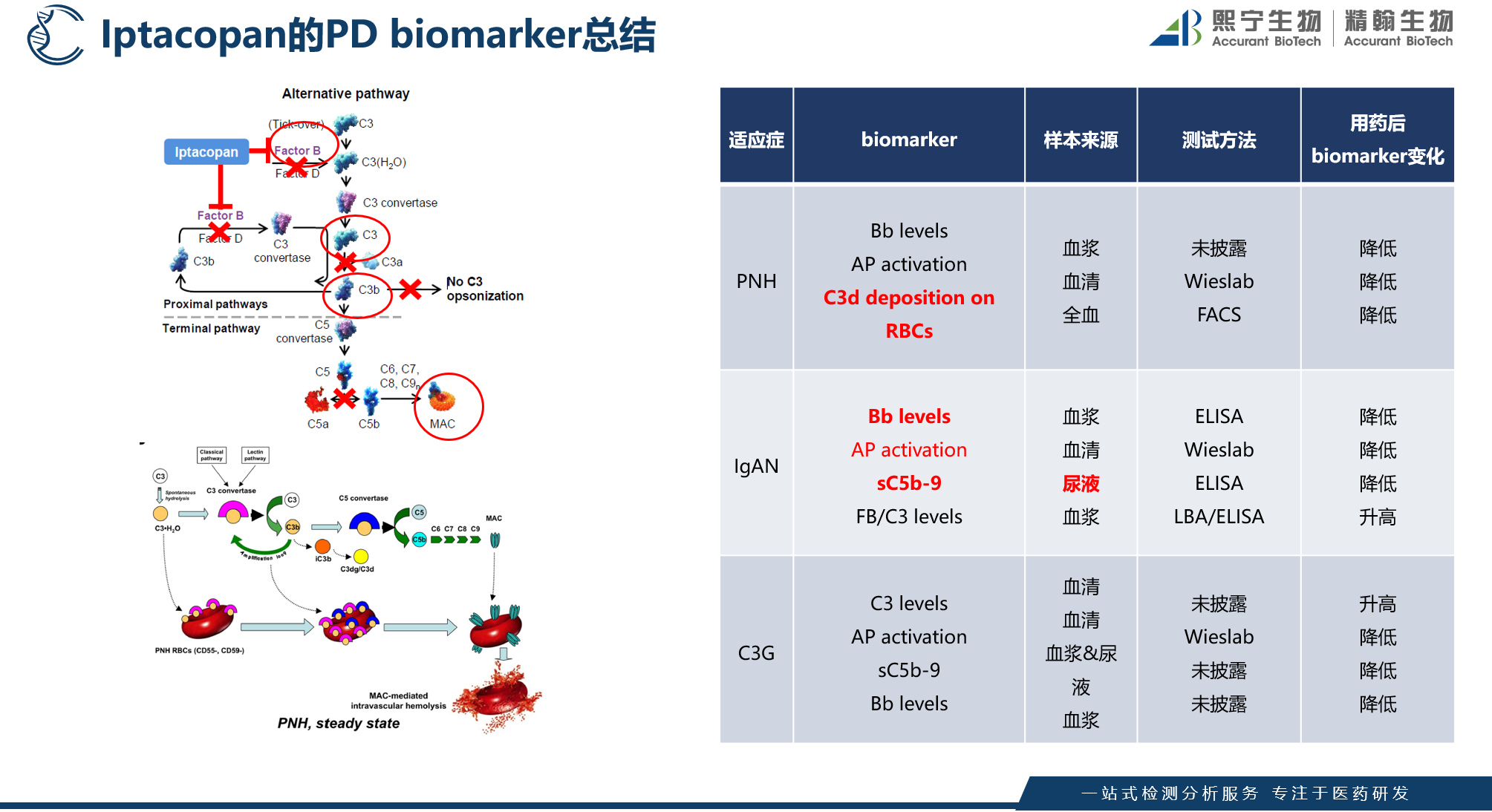
图5 Iptacopan的临床药效学方法
PART 04
熙宁生物|精翰生物的补体系统临床前和临床药效学分析服务
基于熙宁生物丨精翰生物临床阶段的补体信号通路药效评估经验,补体信号通路药效学表征有以下难点:
➢
补体三条信号通路既有区别,又有关联,在方法学开发和验证阶段,需要引入EDTA/EGTA、C1q、MBL、CFB、C3/C5抑制剂分组等充分表征药效学模型的特异性,对方法学和检测结果进行科学解读;
➢
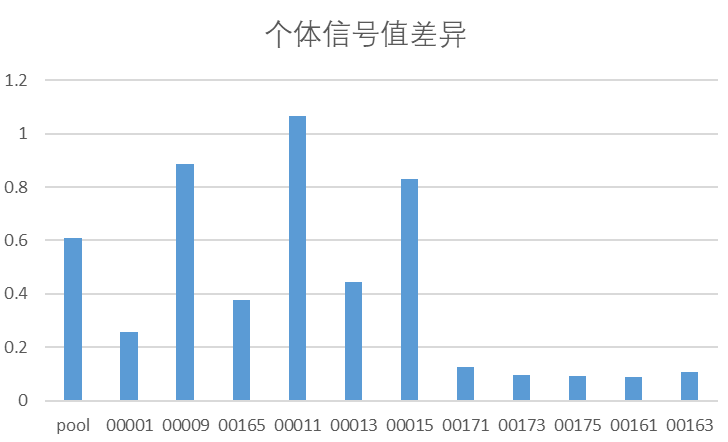
补体凝集素途径的活跃程度存有较大的个体差异,补体旁路途径的活跃程度有人种差异和性别差异,需要基于大样品量的个体血清基质对检测结果进行充分的解读;
➢
补体信号通路涉及到的成分复杂,信号通路级联反应跨度大,个体差异较大,需要从多角度,多维度对方法学和数据进行解读,需要从生物标志物水平,信号通路水平,细胞裂解水平进行转化医学研究;
➢
旁路途径激活受到凝集素途径和经典途径的影响,旁路途径抑制剂具备更加广谱的补体活性抑制作用,适应症选择范围更广;凝集素途径个体差异较大,建议基于凝集素途径的活跃程度进行患者筛选入排。
熙宁生物|精翰生物拥有丰富的基于人血清样品进行补体信号通路药效学评估的方法开发、验证和样品分析经验,可提供补体激活信号通路中经典途径、凝集素途径和旁路途径的药效学分析服务,包括WIESLAB信号通路水平,红细胞裂解/肿瘤细胞裂解水平,补体生物标志物ELISA水平全方面的临床前转化医学研究和临床阶段药效生物分析服务, 欢迎后台留言咨询。
熙宁|精翰相关补体检测项服务项和项目经验(部分)如下表:

图6 熙宁丨精翰补体药效方法学库
熙宁丨精翰补体药效检测项目和转化医学研究经验(部分)如下图:
经典途径细胞杀伤抑制
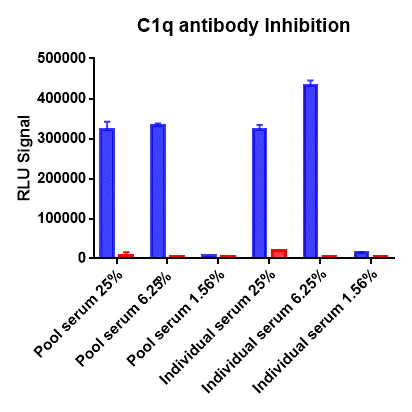
凝集素途径激活的个体差异
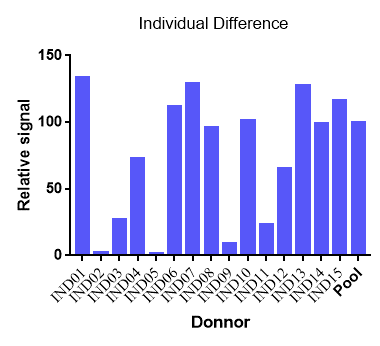
旁路途径激活性别差异
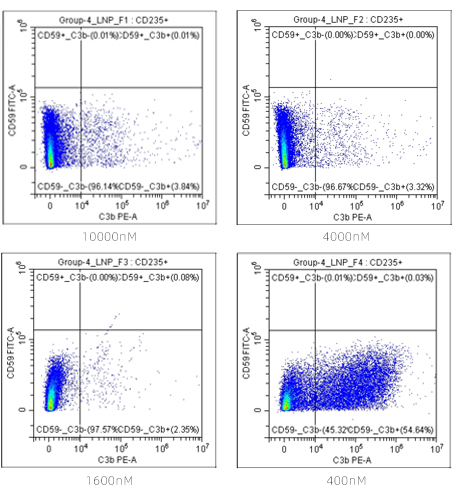
旁路途径PNH患者的C3b沉积以及Iptacopan药效相关性
对照药物LNP023