



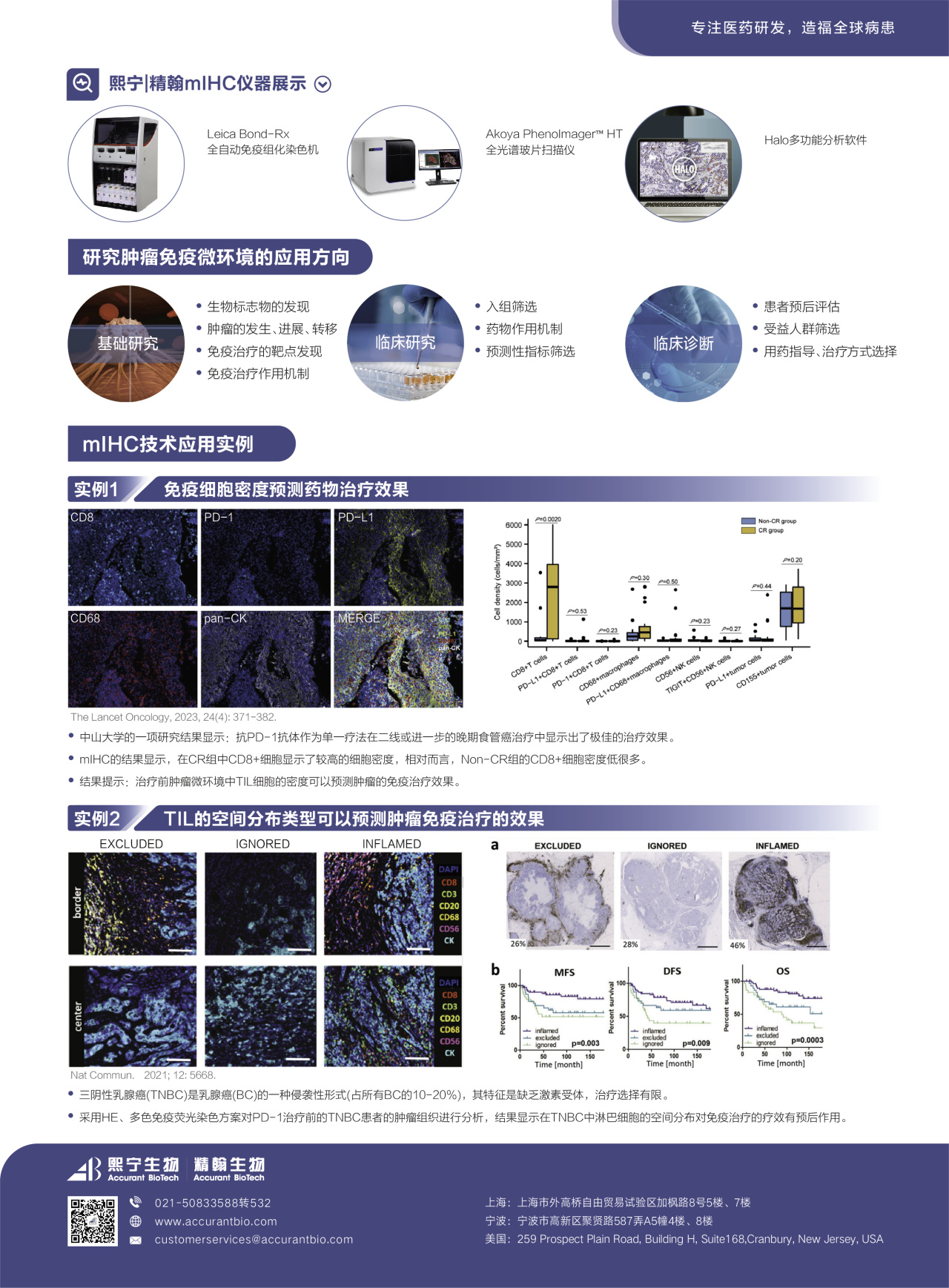
肿瘤免疫疗法,如免疫检查点抑制剂(ICIs),已被证明在治疗多种人类癌症中发挥了重要作用,如黑色素瘤、非小细胞肺癌(NSCLC)和肾细胞癌等[1]。此外,患者肿瘤组织内的免疫细胞亚群分布、相关细胞因子含量、免疫抑制状态等已被用于多种类型癌症的生存和预后研究[2]。同时,一些回顾性或探索性研究也显示了肿瘤免疫微环境的状态在预测肿瘤免疫治疗效果方面的效果。
PART 01
mIHC/mIF在肿瘤免疫治疗研究中的优势
早期,传统IHC/IF显色方法为深入了解免疫浸润在指导后续临床治疗反应中的作用提供了有价值的工具。但是,传统IHC方法最大的局限性是在一张FFPF切片上只能对1 -3个靶标进行染色,而对于肿瘤免疫浸润的评估,需要对多个蛋白靶点进行检测,这就要求充足的组织学标本,但大多数的活检样本无法满足。相比之下,基于多重免疫组织化学/免疫荧光(mIHC/mIF)的分析可实现在一张FFPE组织切片上进行多个生物标志物检测,进而提供对包含浸润性免疫细胞、癌细胞和基质细胞在内的复杂肿瘤微环境(TME)中各种细胞含量、分布以及空间关系的独特视角 [3]。因此,mIHC技术可以在肿瘤免疫治疗的研究中发挥重要的作用。
此外,mIHC/mIF在预测ICIs治疗效果方面可能具有更高的准确性。Lu等人荟萃分析了来自50多个研究的抗PD-1/PD-L1治疗数据,涵盖10多种肿瘤类型和8000多名患者,使用ROC和AUC来检验多种生物标志物,如PD-L1 IHC、肿瘤负荷(TMB)、基因表达谱(GEP)和mIHC/mIF在预测PD-1/PD-L1抑制剂疗效方面的准确性。结果显示,与其他三种检测类型相比,mIHC/mIF检测的预测准确性最高(图1)[4]。
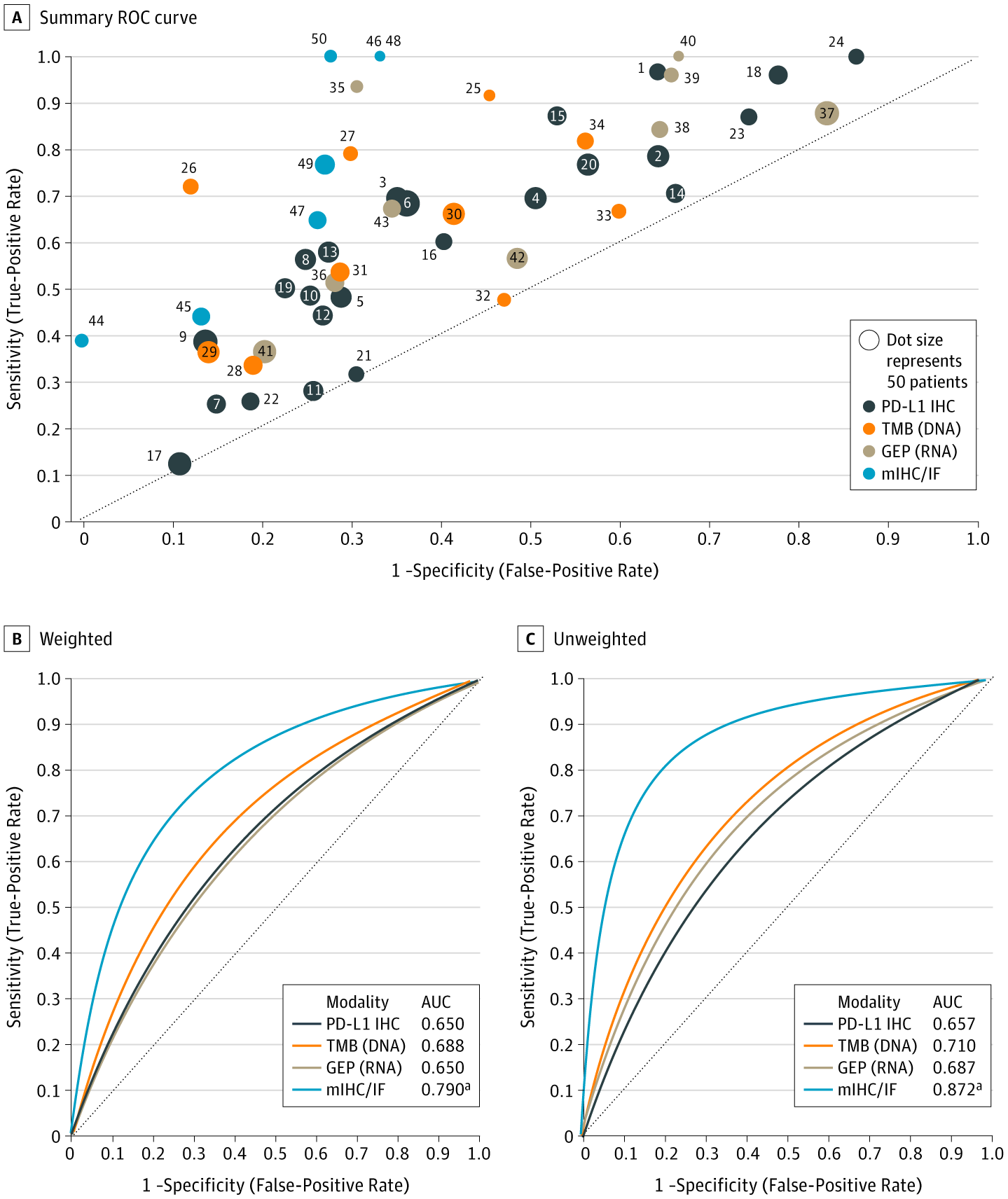
图1 不同生物标志物与抗PD-1/PD-L1治疗后患者反应的相关性[4]
PART 02
mIHC/mIF的预后和预测价值实例
目前,已有多个实验室利用mIHC/mIF技术研究多种类型癌症患者肿瘤组织内免疫亚群的预后甚至预测价值。
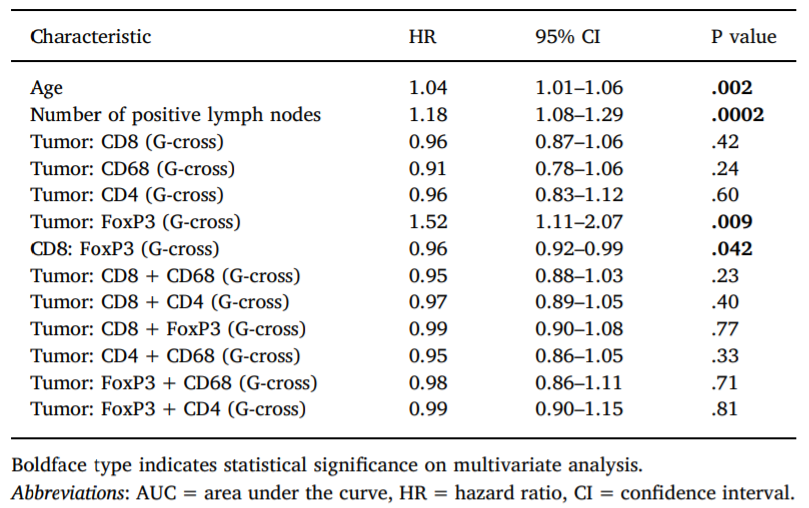
Barua等人[5]利用mIHC方法对120例I-III期非小细胞肺癌患者的肿瘤标本进行分析,探讨肿瘤微环境中肺癌细胞与特异性免疫细胞空间接近程度对预后的影响。该研究对CD8、CD4、Foxp3和CD68进行标记,然后利用一种新的G-cross空间距离分布方法分析每种细胞类型的丰度和空间位置以及它们彼此之间的接近程度,采用Cox比例风险多元回归分析淋巴细胞类型接近程度的影响。结果显示(表1),肿瘤细胞与Foxp3+ Treg细胞相互作用的G-cross函数的曲线下面积(AUC)越大,经年龄和阳性淋巴结数调整后的生存率越差(HR 1.52 (1.11-2.07), P = 0.009),表明在非小细胞肺癌中,核心肿瘤区域浸润Treg细胞的增加是总生存率较差的独立预测因子。然而,Treg-CD8的G-cross AUC越大,经年龄和阳性淋巴结数调整后的生存率越高(HR 0.96 (0.92-0.99),P = 0.042),说明Treg细胞中CD8+毒性T细胞浸润的增加能够减轻这种效应,并与更好的生存率显著相关。
表1 G-cross AUC评分与临床因素与总生存期的多因素Cox回归分析[5]
T淋巴细胞比例为口腔鳞状细胞癌(OSCC)患者的预后提供了信息。然而,尚未有研究同时评估HPV- OSCC肿瘤内和肿瘤细胞附近免疫细胞的组成和位置,以及肿瘤免疫逃逸机制与临床指标的关联。因此,Feng等人[6]利用mIHC技术对119例 HPV- OSCC患者的肿瘤组织切片进行CD3+、CD8+、FoxP3+、CD163+和PD-L1+细胞成像,然后评估这些marker与患者预后的相关性。结果显示(图2),侵袭边缘大量的CD8+ T细胞与延长的总生存期(OS)显著相关,而FoxP3+或PD-L1+细胞的数量与预后不相关。在这个研究中,最引人注目的是CD8+ T细胞30 μm内FoxP3+或PD-L1+细胞的数量,与靠近CD8+ T细胞的大量抑制因子和总生存期缩短显著相关。
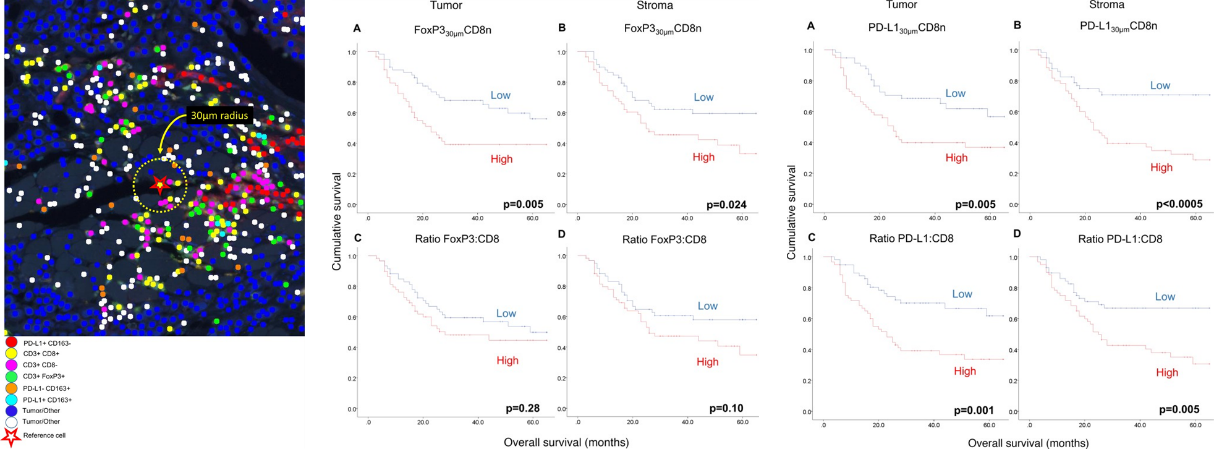
图2 FoxP3+ T细胞、PD-L1+ T细胞与CD8+ T细胞的距离对预后的影响[6]
Johnson等[7]对来自10个肿瘤研究中心166名黑色素瘤患者(发现队列,n = 24; 验证队列,n = 142)在接受抗PD-1治疗前的肿瘤活检组织进行多重荧光染色,选定的生物标志物特征、PD-1/PD-L1相互作用评分和IDO-1/HLA-DR共表达被用来评估抗PD-1治疗的结果。研究表明,发现队列中PD-1/PD-L1相互作用评分和/或IDO-1/HLA-DR共表达与抗PD-1治疗反应密切相关(P = 0.0005)。相比之下,单独的生物标志物(PD-1, PD-L1, IDO-1, HLA-DR)与治疗反应或生存无关。这一发现验证队列中得到了重复:PD-1/PD-L1和/或IDO-1/HLA-DR相互作用高的患者更有可能产生反应(P = 0.0096),这些患者的无进展生存期(HR = 0.36;P = 0.0004)和总生存率(HR = 0.39; P = 0.0011)也得到显著改善。在所有患者中,80% PD-1/PD-L1和IDO-1/HLA-DR相互作用水平较高的患者对PD-1抑制剂有响应(P = 0.000004)。相比之下,PD-L1的表达并不能预测生存率。
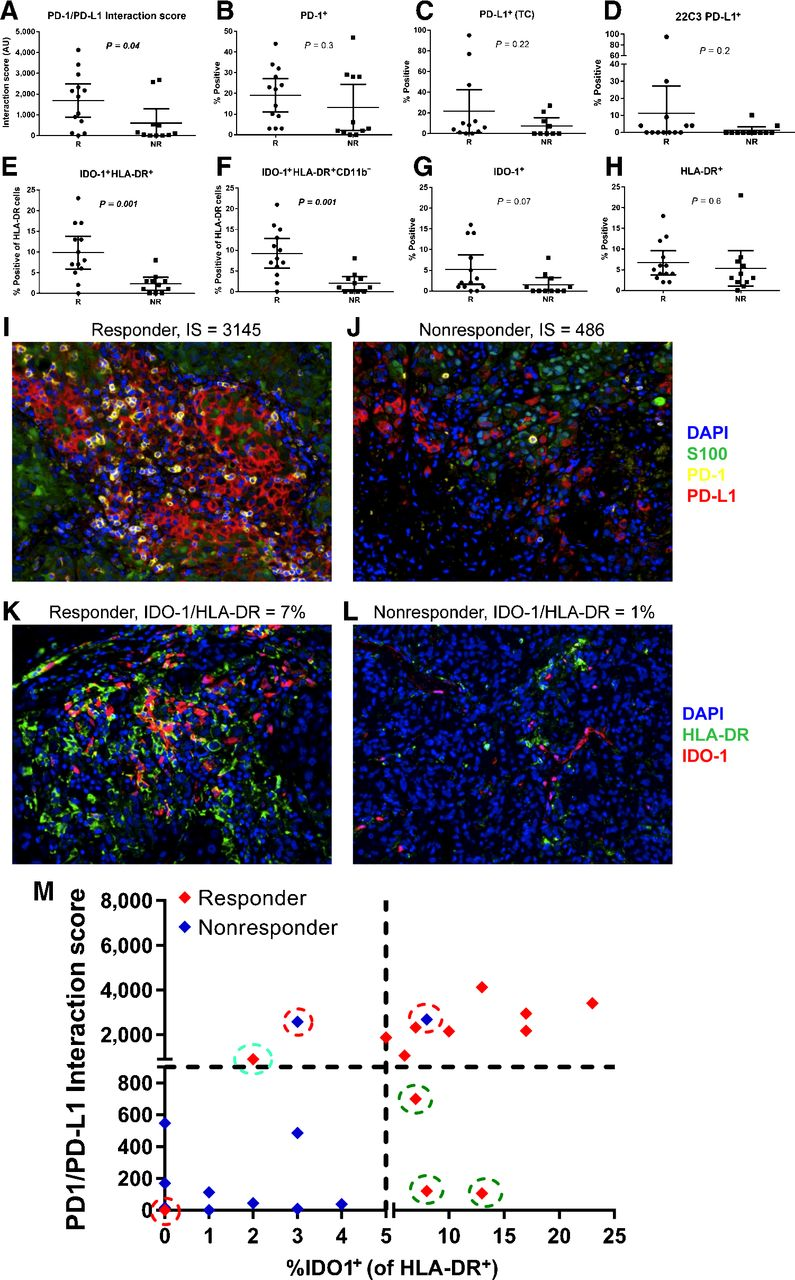
图3 发现队列(n = 24)中应答者(R)和无应答者(NR)候选生物标志物特征的T检验分析[7]
为了确定免疫微环境是否会对非小细胞肺癌的临床结果产生影响,Mazzaschi等[8]对NSCLC患者PD-L1表达、肿瘤浸润淋巴细胞(TIL)与nivolumab治疗效果之间的相关性进行分析,该研究纳入42例腺癌(ADC)和58例鳞状细胞癌(SCC)的手术切除样本以及26例接受nivolumab治疗的晚期患者(13例ADC和13例SCC)的样本进行分析。研究发现, 高密度的PD-1抑制受体低表达的CD8+淋巴细胞亚群与接受手术治疗的NSCLC患者的总生存期呈正相关(OS: HR = 2.268; 95% CI, 1.056-4.871, p = 0.03)。此外,CD8+细胞中PD-1低表达是nivolumab治疗患者的一个显著特征,显示出更长PFS (PFS: HR = 4.51;95% CI, 1.45-13.94, p = 0.004)。上述结果说明PD-1阴性效应T淋巴细胞库对晚期NSCLC切除术患者的生存和免疫治疗反应具有积极影响。

图4 Kaplan-Meier曲线显示PD-1-to-CD8 (D, F)和CD8-to-CD3 (E, G)分别对免疫治疗晚期NSCLC患者DFS (D, E)和OS (F, G)的预测作用[8]
PART 03
小结
在肿瘤免疫治疗时代,虽然免疫检查点抑制剂(ICI)改善了晚期恶性肿瘤患者的生存和预后,但复杂的耐药机制限制了临床疗效,需要更准确的预后和预测性生物标志物。新兴的mIHC/mIF技术使我们能够更好地表征TME,提供肿瘤组织内的免疫细胞亚群的含量和空间排列的全面信息,识别新的生物标志物,将有助于更好地预测肿瘤免疫治疗的临床疗效,揭示免疫治疗药物的作用机理,指导临床用药。总之,mIHC/mIF在癌症免疫治疗领域具有广阔的应用前景。
PART 04
熙宁生物|精翰生物mIHC经验
熙宁生物|精翰生物组织病理实验室mIHC平台配备了高标准的徕卡Bond Rx全自动免疫组化染色机、Akoya PhenoImager全光谱成像系统以及Halo数字病理图像分析平台等重量级设备及分析系统,可提供自动化,高质量的mIHC研究全流程解决方案。从panel设计,panel验证,以及样本检测等方面提供全方位的支持。可为广大药企提供高品质的临床前、临床试验阶段的组织样本mIHC检测。
欢迎后台留言咨询。

参考文献:
[1] Sun Z, et al. Developing an enhanced 7-color multiplex IHC protocol to dissect immune infiltration in human cancers. PLoS One. 2021 Feb 17;16(2):e0247238. doi: 10.1371/journal.pone.0247238. PMID: 33596250.
[2] Galon J, et al. Towards the introduction of the 'Immunoscore' in the classification of malignant tumours. J Pathol. 2014 Jan;232(2):199-209. doi: 10.1002/path.4287. PMID: 24122236.
[3] Tan WCC, et al. Overview of multiplex immunohistochemistry/immunofluorescence techniques in the era of cancer immunotherapy. Cancer Commun (Lond). 2020 Apr;40(4):135-153. doi: 10.1002/cac2.12023. Epub 2020 Apr 17. PMID: 32301585
[4] Lu S, et al. Comparison of Biomarker Modalities for Predicting Response to PD-1/PD-L1 Checkpoint Blockade: A Systematic Review and Meta-analysis. JAMA Oncol. 2019 Aug 1;5(8):1195-1204. doi: 10.1001/jamaoncol.2019.1549. PMID: 31318407.
[5] Barua S, et al. Spatial interaction of tumor cells and regulatory T cells correlates with survival in non-small cell lung cancer. Lung Cancer. 2018 Mar;117:73-79. doi: 10.1016/j.lungcan.2018.01.022. Epub 2018 Feb 4. PMID: 29409671.
[6] Feng Z, et al. Multiparametric immune profiling in HPV- oral squamous cell cancer. JCI Insight. 2017 Jul 20;2(14):e93652. doi: 10.1172/jci.insight.93652. PMID: 28724788.
[7] Johnson DB, et al. Quantitative Spatial Profiling of PD-1/PD-L1 Interaction and HLA-DR/IDO-1 Predicts Improved Outcomes of Anti-PD-1 Therapies in Metastatic Melanoma. Clin Cancer Res. 2018 Nov 1;24(21):5250-5260. doi: 10.1158/1078-0432.CCR-18-0309. Epub 2018 Jul 18. PMID: 30021908.
[8] Mazzaschi G, et al. Low PD-1 Expression in Cytotoxic CD8+ Tumor-Infiltrating Lymphocytes Confers an Immune-Privileged Tissue Microenvironment in NSCLC with a Prognostic and Predictive Value. Clin Cancer Res. 2018 Jan 15;24(2):407-419. doi: 10.1158/1078-0432.CCR-17-2156. Epub 2017 Oct 26. PMID: 29074606.