



上文熙宁小课-第146期 | 免疫组库测序打开药物研发新视野(五):TCR免疫组库测序在肿瘤免疫治疗中的应用(上)以TRB为例,从克隆多样性、CDR3长度分布、V-J基因使用频率分布等方面对单个样本的TCR免疫组库测序结果进行了简单展示。
本文将对受检者*经治疗后的不同时间节点的样本进行 T 细胞受体基因克隆鉴定检测,对每个样本 TCR 的克隆比例、克隆多样性、V/J 基因的使用频率进行统计,识别样本间的共有克隆,并追踪不同样本 TCR 指标的动态变化,如克隆总数、克隆类型、多样性指数、克隆丰度等,以TRB为例进行展示(注:图示中所有数据均来自虚拟样本)。
PART 01
免疫监测为肿瘤免疫治疗提供临床指导
在肿瘤免疫治疗中,通过 TCR 免疫组库测序追踪同一个患者在不同时间节点的T细胞克隆类型与比例变化,可以提供非常重要的临床信息和指导意义:
·
治疗反应监测:观察到特定的TCR克隆在治疗前后或治疗期间的相对稳定或显著扩增,可能指示这些克隆对应T细胞具有有效的抗肿瘤活性,这对于评估免疫治疗效果至关重要。若治疗后这些效应T细胞克隆比例上升,则提示治疗起效,反之则可能提示治疗失败或耐药;
·
免疫监测与复发预警:如果治疗后原本消失或减少的肿瘤相关TCR克隆再次升高,可能预示着肿瘤复发或进展。通过实时监测TCR谱的变化,可以提前发现病情变化,指导临床决策;
·
治疗反应预测:识别出患者体内预先存在的抗肿瘤TCR克隆,可以预测患者对某些免疫疗法(如免疫检查点抑制剂、T细胞受体工程改造疗法等)的响应可能性;
·
免疫逃逸机制研究:分析肿瘤微环境中TCR克隆的动态变化,有助于揭示肿瘤如何通过免疫编辑过程实现免疫逃逸,从而改进现有治疗策略,开发新的治疗手段。
PART 02
时序样本TCR免疫组库测序结果
注:下图中的样本信息和结果均来自模拟数据

2.1 样本间共有克隆分析
统计多个样本的共有克隆的数目,结果见图1,根据多个样本的CDR3序列及频率绘制聚类热图,结果见图2。
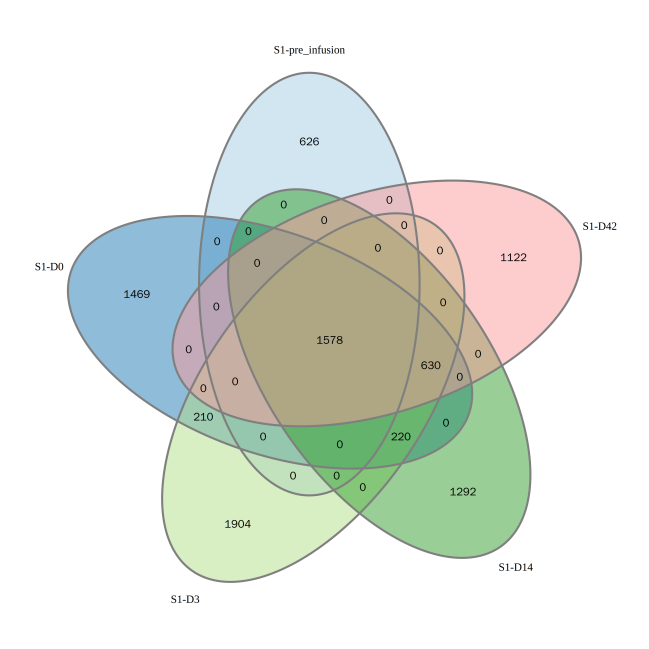
图1 多个样本克隆类型一致性venn图
上图为多个样本中克隆类型一致性分布的韦恩图。该图支持2~5个样本的可视化,图中的数字表示重叠样本的共有克隆的数目。
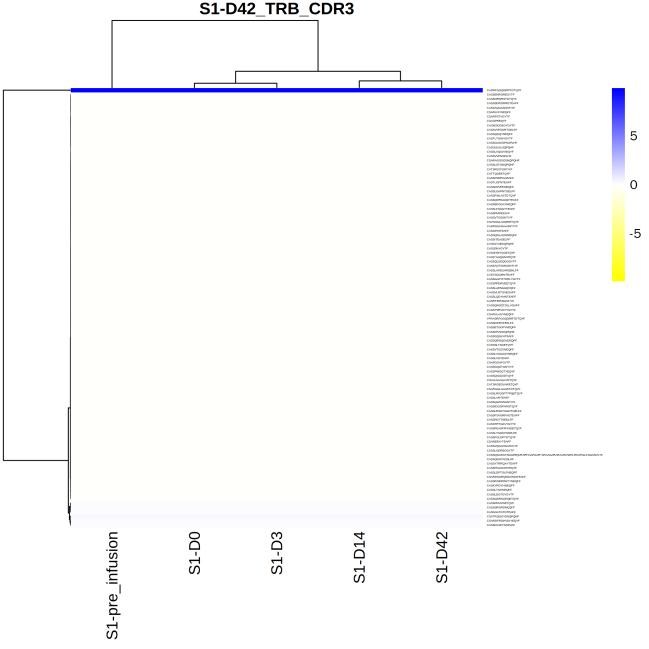
图2 多个样本共有克隆表达量聚类热图
上图为不同样本的克隆频率聚类热图,其中,每一列为一个样本,每一行为一种克隆。按克隆类型进行聚类,反应样本间的克隆分布的相似性。蓝色表示该克隆在对应样本中克隆频率较高,黄色表示该克隆在对应样本中克隆频率较低。
不同样本中可能存在相同的克隆,依据克隆在样本中共同存在的情况,有助于分析组间、组内的差异和共性,有助于分析寻找疾病特异性克隆。
如果一个或几个特定的T细胞克隆在治疗前后的不同样本中持续存在且比例增加,这可能表明这些克隆具有针对肿瘤的有效免疫反应。特别是在免疫治疗后,同一克隆的增多可能代表这些T细胞成功地识别并消灭了肿瘤细胞,提示治疗有效。
若在治疗后较长时间内,仍然能在患者体内检测到相同的效应T细胞克隆,尤其是那些肿瘤特异性T细胞克隆,这可能意味着患者已经建立了持久的免疫记忆,有利于防止肿瘤复发。
相反,若治疗后,原本预期应被激活的特定克隆并未显著扩增或反而减少,这可能暗示肿瘤出现了免疫逃逸机制或者患者对当前治疗不敏感,提示治疗可能无效或产生了耐药性。

2.2 样本间 V/J 基因使用频率分析
统计每个样本中 V,J 基因的使用频率,结果见图3 与图4。
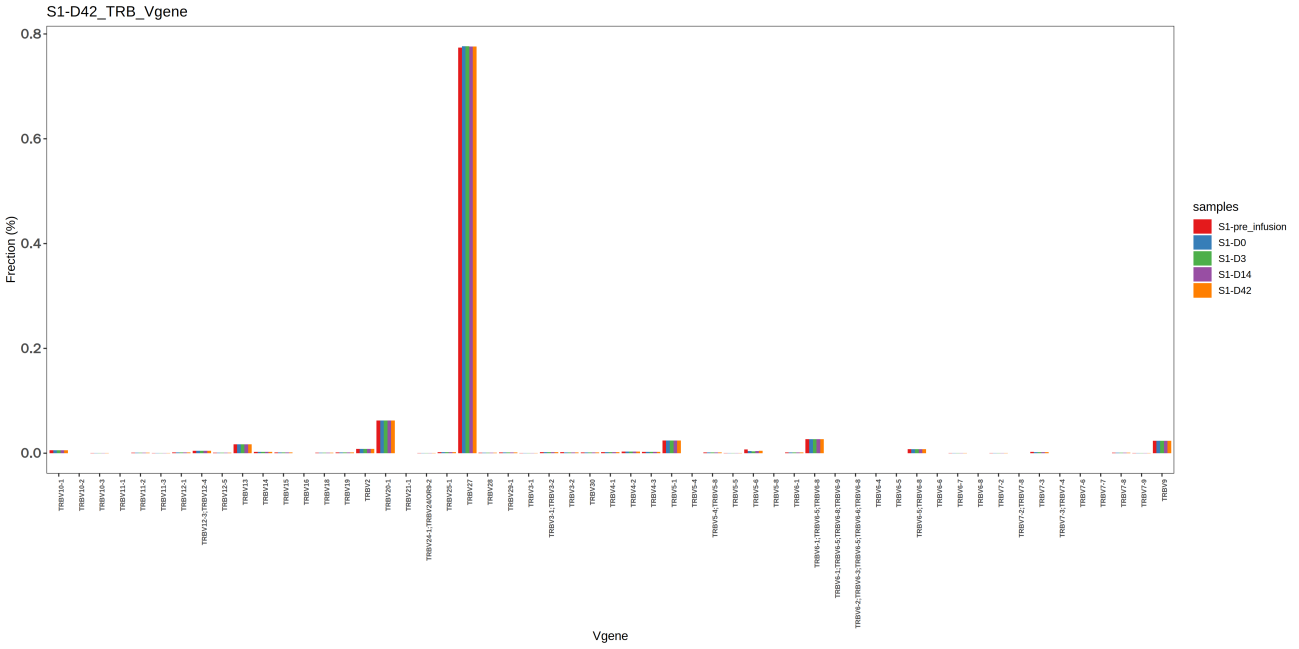
图3 不同样本V基因频率分布柱状图
上图为不同样本的 V 基因频率分布柱状图,其中,X轴表示不同的 V 基因,Y轴表示克隆频率,不同的样本由不同颜色表示。
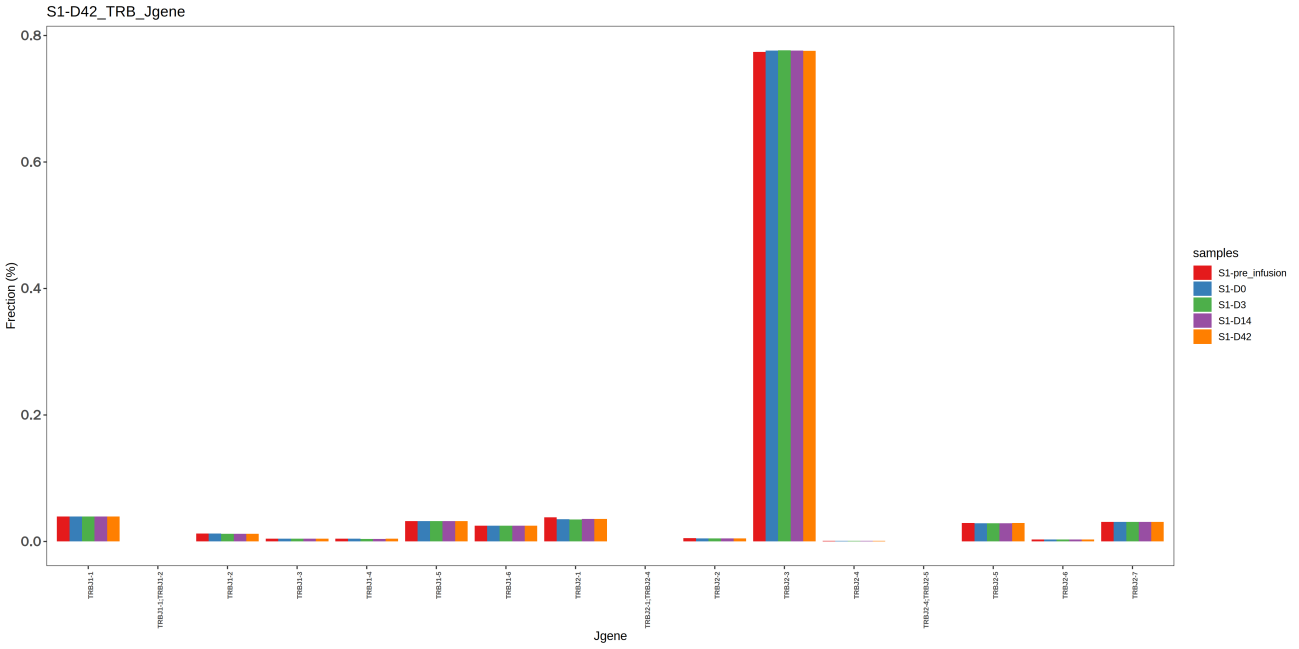
图4 不同样本J基因频率分布柱状图
上图为不同样本的 J 基因频率分布柱状图,其中,X轴表示不同的 J 基因,Y轴表示克隆频率,不同的样本由不同颜色表示。
当免疫治疗有效时,通常伴随着肿瘤特异性T细胞的激活和扩增。这些T细胞可能具有特定的TCR结构,其V和J基因的使用频率会在治疗后显著增加。因此,如果发现某些V/J基因组合的频率在治疗后有所升高,可能说明这些T细胞正积极地参与对抗肿瘤,从而提示治疗效果良好。
另一方面,如果预期应该对治疗产生反应的特定V/J基因使用频率未见明显上升,甚至减少,可能提示肿瘤正在通过免疫逃逸机制躲避T细胞攻击,或者治疗未能有效激活相应的抗肿瘤T细胞克隆,从而提示治疗效果不佳或产生耐药性。

2.3 多时间节点动态分析
由于样本存在时序关系,为展示不同时间点样本间 TCR 重组序列的变化情况,对多个样本的克隆数、克隆类型、多样性指数、克隆分率分布等进行统计,见图5-7,筛选了每个样本表达量最高的前20条克隆组成新的克隆群,追踪该克隆群体在不同样本间克隆频率的变化,见图8。
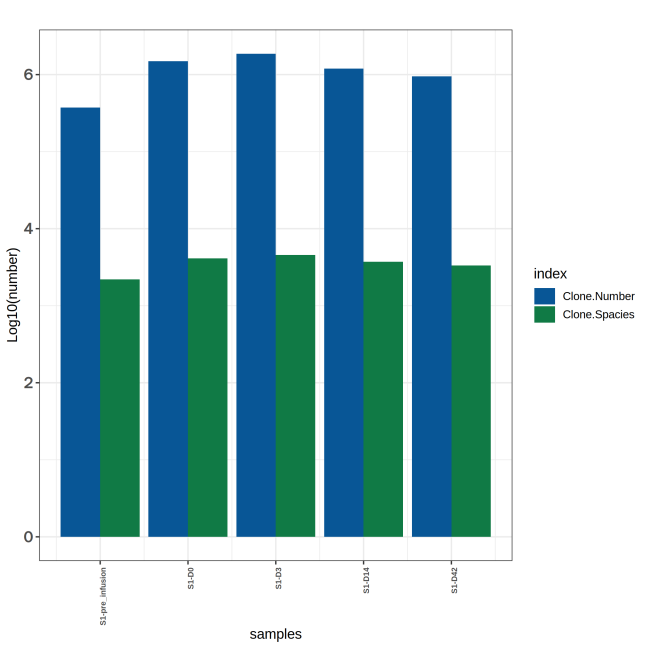
图5 不同时间节点样本高频克隆的TCR指标动态变化折线图
上图为不同时间节点样本的 TCR 克隆数统计图。X轴为不同时间节点的样本,柱形图展示了不同样本的 TRB 的克隆类型与克隆总数,Y轴为Log10(克隆数)。
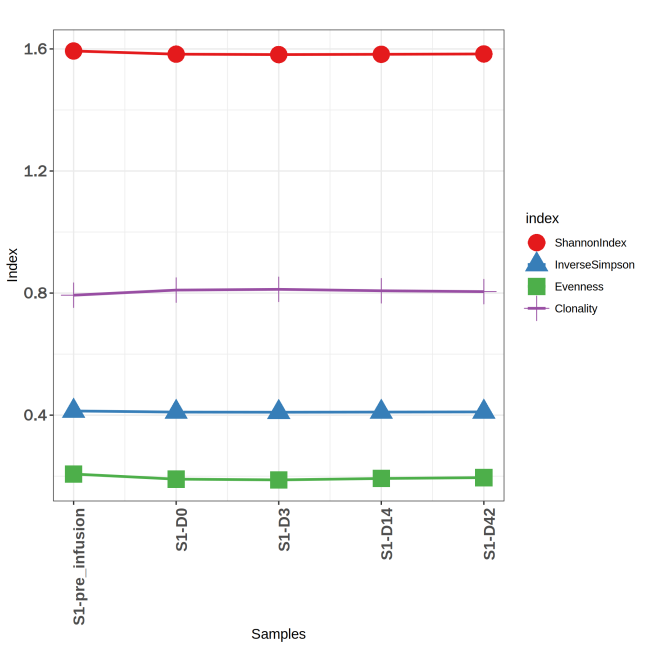
图6 多样性指数变化折线图
上图为不同时间节点样本的 TCR 多样性指数统计图。X轴为不同时间节点的样本,折线图展示了不同样本的 TRB 的克隆克隆多样性指数。
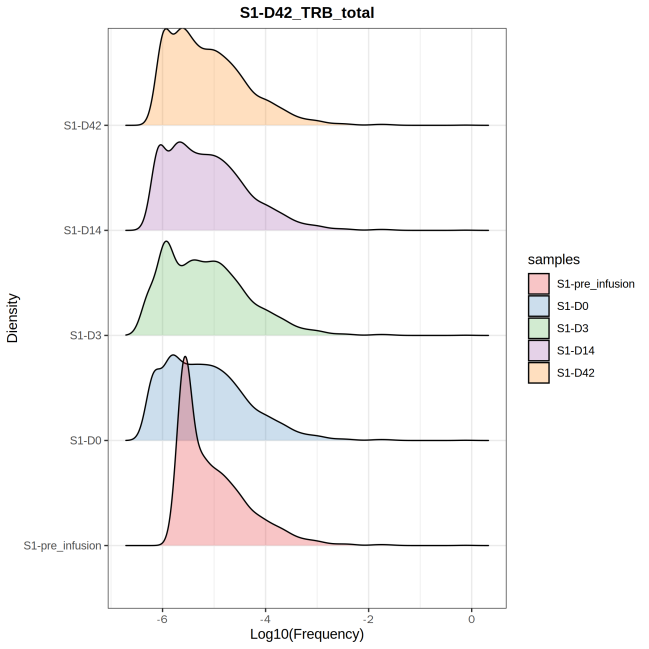
图7 不同样本的克隆丰度组成累计频率分布图
上图为多个样本的克隆丰度的密度分布图。其中 X 轴 Log10(克隆频率), Y 轴表示处于该区间的克隆频率的百分比。反应不同样本的克隆丰度组成变化情况。
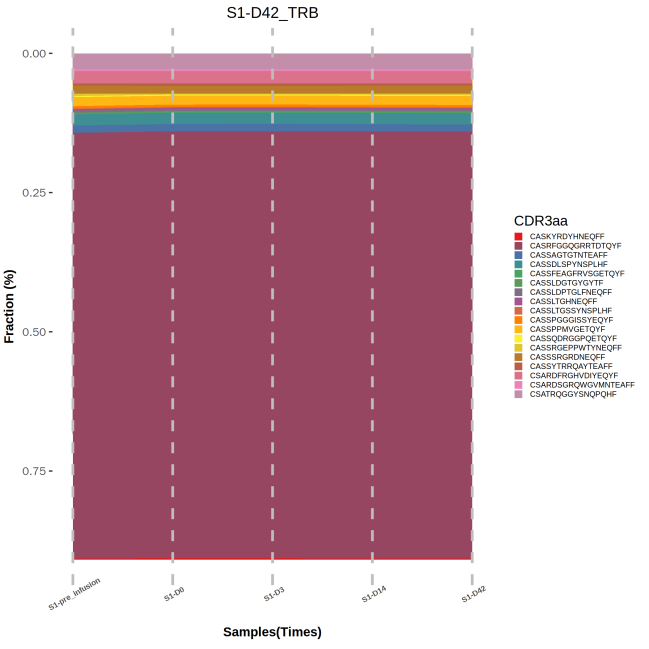
图8 不同时间节点样本高频克隆的频率变化追踪图
上图为时序样本特定克隆的堆叠面积图,其中,X轴表示不同的时间节点(不同样本),阴影面积的大小反应克隆频率的大小。不同样本间的共有克隆由相同的颜色表示。
在肿瘤免疫治疗中,不同样本中T细胞克隆的丰度和多样性指数的变化能够从一定程度反映肿瘤治疗的临床效果。
有效的免疫治疗可能导致T细胞库的多样性增加,这是因为有更多的肿瘤特异性T细胞被激活和扩增,增加了整体T细胞克隆的多样性,这是免疫系统响应的一种积极信号;在某些情况下,治疗后T细胞多样性降低可能是因为少数高效应T细胞克隆占据了优势,这在一定程度上可能反映出了治疗的成功,但如果整体多样性降低过于显著,也可能提示免疫系统整体功能受限或偏向单一反应,不利于长期控制肿瘤;对于免疫衰老或肿瘤导致的T细胞多样性丧失,治疗后多样性趋于稳定或恢复,可能表明治疗有助于重建健康的免疫平衡,有利于治疗效果的持久性。
通过全面分析克隆丰度和多样性指数的变化,可以帮助临床医生评估治疗策略的有效性、预后以及耐药性,同时也为个体化治疗方案的制定提供了科学依据。

2.4 TILs 来源的克隆残留比例追踪
在肿瘤微环境中,TILs的克隆组成反映了机体对肿瘤的免疫反应强度和特异性。在 TILs(Tumor-Infiltrating Lymphocytes) 介导的肿瘤免疫治疗过程中对TILs在血液和肿瘤组织中的残留量、活性和克隆分布的连续监测有助于了解治疗效果和调整后续治疗策略。
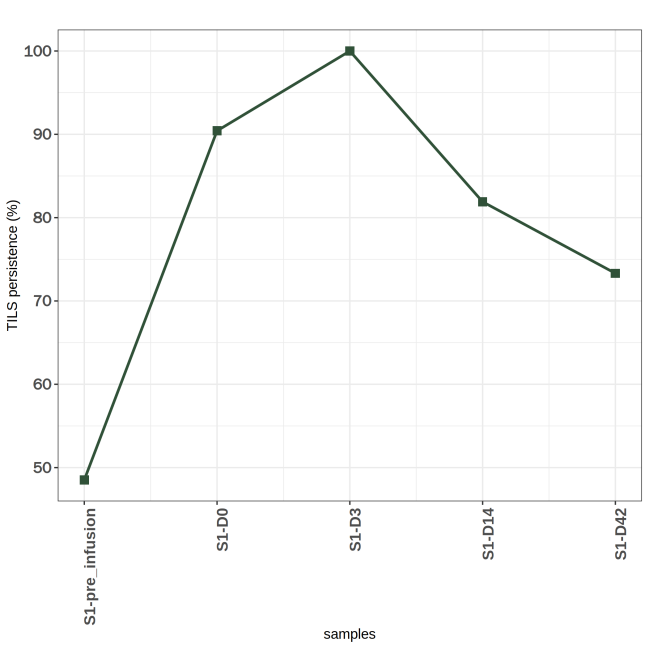
图9 样本TILs来源的TRB克隆残留比例折线图
上图为样本TILs 来源的 TRB 克隆残留比例折线图,其中,X轴表示不同的时间节点(不同样本),纵坐标表示克隆残留比例(%)。
TILs 注射后在患者体内的残留比例变化取决于多种复杂因素,包括体内归巢与增殖、免疫抑制微环境、免疫抑制剂的联合使用、TILs的质量和纯度、患者个体差异等,这些因素相互作用影响TILs在体内的持久性、增殖能力、抗肿瘤活性以及最终的治疗效果。

2.5 样本相似性计算及聚类
当样本数>3时,统计样本间的克隆序列分布相似性指数:Morisita’s overlap index。根据相似性对样本进行聚类,结果见图10。Morisita 重叠指数的计算公式为:
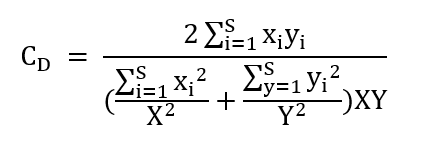
xi 是克隆 i 在一个克隆总数为 X 的样本中出现的次数。
yi 是克隆 i 在一个克隆总数为 Y 的样本中出现的次数。
S 是克隆类型总数。
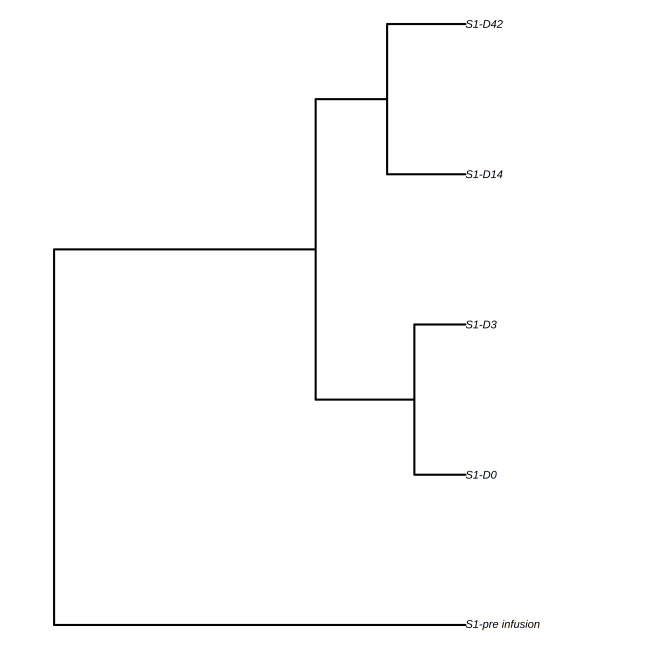
图10 多样本相似性聚类树状图
上图展示了多个样本的树状结构,分支长度显示了样本克隆序列之间的距离。
不同治疗组间的聚类可以区分出对治疗响应良好和不良的患者群体,通过比较治疗前后的TCR谱系变化,可以判断治疗是否有效激活了肿瘤特异性T细胞反应;不同类型的肿瘤或疾病阶段具有独特的TCR谱系特征,聚类分析可以帮助细化疾病分型,甚至预测疾病进展或转归;分析肿瘤样本和正常对照之间的TCR克隆差异,可以识别出可能与肿瘤免疫逃逸相关的TCR克隆,从而深入了解肿瘤如何规避免疫监视。多组样本TCR免疫组库测序的样本聚类分析有助于深入了解免疫系统在肿瘤发病和治疗过程中的动态变化,为临床提供更精准的诊断、预后判断以及个体化治疗方案设计。
PART 03
小结
免疫组库检测方法揭示了免疫系统多样性和克隆扩增状态,除了用于肿瘤的免疫治疗外,还可用于研究病原体感染过程中宿主免疫反应的多样性、识别关键抗体序列;探究自身免疫疾病的发病机制及其潜在治疗靶点;研究移植后宿主对移植物的免疫反应,为优化移植后免疫抑制方案提供依据。由此可知,免疫组库检测技术已经成为现代生物医药研发的重要工具,不仅促进了免疫疗法的进步,也在多种治疗领域发挥了关键作用。
熙宁|精翰NGS实验室应用基于多重PCR建库的免疫组库检测方法特异性地扩增TCR/Ig受体链编码基因(TRB、TRD、TRG,以及IgH、IgL、IgK),检测T/B细胞受体基因的克隆性重排,在时序样本检测中,通过检测患者体内TCR谱系的变化来评估治疗效果以及跟踪疾病进展或复发。本检测方法已经经过了完善的性能验证,可以供申办方直接使用。
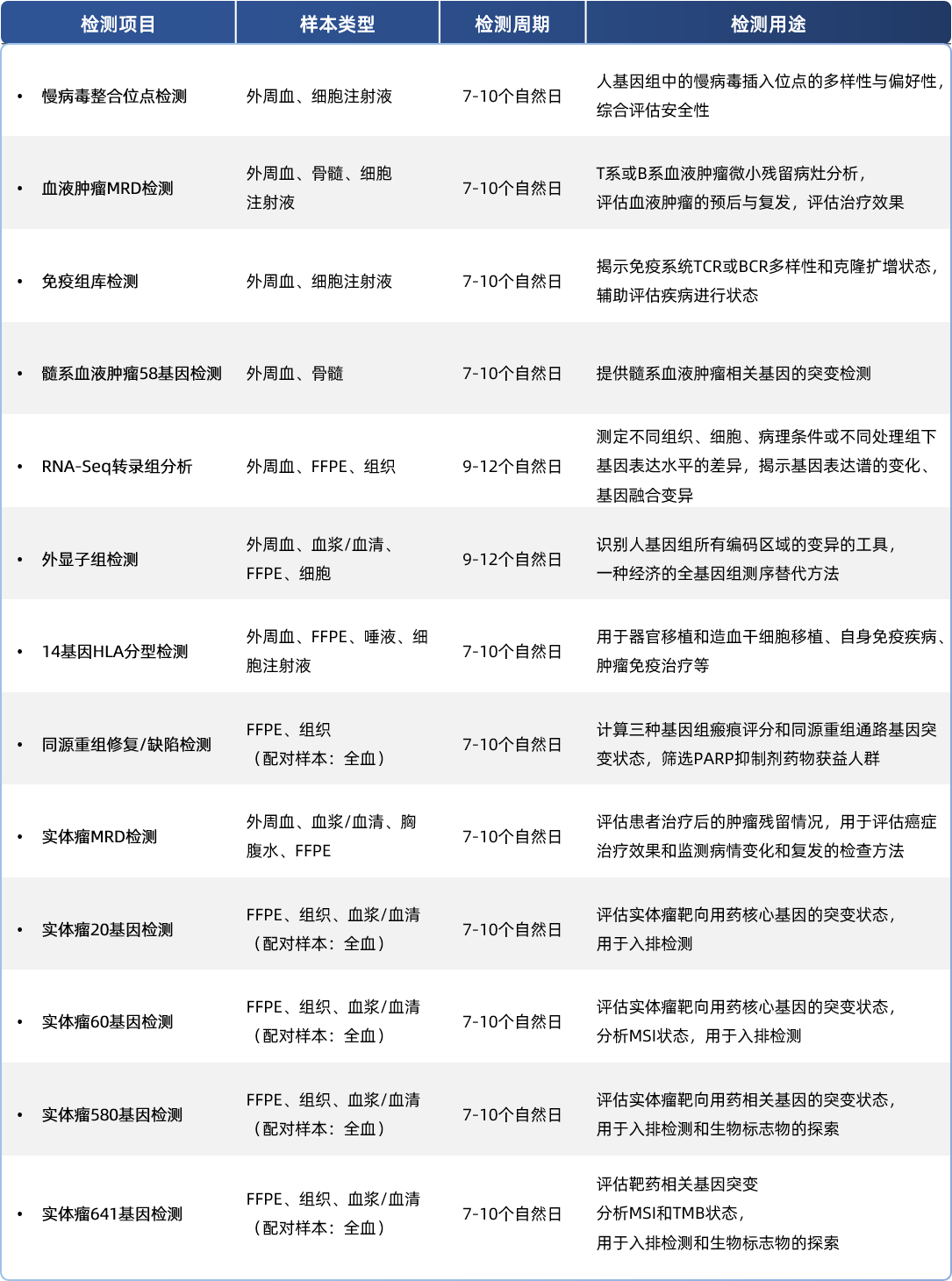
熙宁|精翰NGS实验室依据CAP质量的要求,建立了完善的质量体系。实验室拥有NextSeq CN500测序仪,支持本地测序,且多次满分通过CAP的能力验证。按照质量体系的要求,实验室建立了丰富的检测方法,全面支撑药物的安全性评估、治疗效果评估、入组筛查和生物标志物的探索等,在药物研发的各个环节发挥重要作用:
➢
以慢病毒为载体的CAR-T细胞治疗中,识别有致瘤性的或者其他潜在危险的整合位点,评估整合事件的多样性和偏好性,辅助评估药物潜在的安全性风险;
➢
通过对肿瘤微小残留病灶(MRD)的检测,评估药物治疗效果并提示预后,提前提示复发风险并指导后续干预;
➢
通过基因组和转录组测序,帮助申办方识别与疾病关联的基因突变、融合突变和拷贝数变异等,识别受试者药物靶点变异情况,以及与药物转运、代谢和相关信号通路的基因变化,从而指导患者入排,发现药物研发的潜在靶点和生物标志物,并指导耐药机制研究和新的治疗策略开发;
➢
评估候选药物对基因表达的影响,筛选出对特定靶标有显著作用的化合物,同时通过分析药物处理前后基因表达变化,优化药物的剂量、作用机制和潜在副作用。
欢迎后台留言咨询。
参考文献:
[1] Zhang W, Du Y, Su Z, et al. IMonitor: a robust pipeline for TCR and BCR repertoire analysis[J]. Genetics, 2015, 201(2): 459-472.
[2] Wang T, Wang C, Wu J, et al. The different T-cell receptor repertoires in breast cancer tumors, draining lymph nodes, and adjacent tissues[J]. Cancer immunology research, 2017, 5(2): 148-156.
[3] Chen S Y, Yue T, Lei Q, et al. TCRdb: a comprehensive database for T-cell receptor sequences with powerful search function[J]. Nucleic acids research, 2021, 49(D1): D468-D474.
[4] Shugay M, Bagaev D V, Turchaninova M A, et al. VDJtools: unifying post-analysis of T cell receptor repertoires[J]. PLoS computational biology, 2015, 11(11): e1004503.
[5] Tang J, Pearce L, O'Donnell-Tormey J, et al. Trends in the global immuno-oncology landscape[J]. Nat. Rev. Drug Discov, 2018, 130(176): 112.
[6] Zhao Q, Jiang Y, Xiang S, et al. Engineered TCR-T cell immunotherapy in anticancer precision medicine: pros and cons[J]. Frontiers in immunology, 2021, 12: 658753.
[7] Sarnaik A A, Hamid O, Khushalani N I, et al. Lifileucel, a tumor-infiltrating lymphocyte therapy, in metastatic melanoma[J]. Journal of Clinical Oncology, 2021, 39(24): 2656.
[8] Pai J A, Satpathy A T. High-throughput and single-cell T cell receptor sequencing technologies[J]. Nature methods, 2021, 18(8): 881-892.
[9] Jiang, X., et al., Comprehensive TCR repertoire analysis of CD4(+) T-cell subsets in rheumatoid arthritis. J Autoimmun, 2020. 109: p. 102432.
[10] Liu, X., et al., T cell receptor beta repertoires as novel diagnostic markers for systemic lupus erythematosus and rheumatoid arthritis. Ann Rheum Dis, 2019. 78(8): p. 1070-1078.