



在探索疫苗研究前沿:细胞免疫原性的应用与挑战(上)一文中,我们已经对细胞免疫原性在新冠疫苗、VZV疫苗、肿瘤治疗性疫苗,以及新佐剂研究中的应用进行了介绍。承接前文,本文将继续针对细胞免疫在疫苗临床研究中的应用和难点进行探讨。
PART 01
疫苗相关指导原则对细胞免疫原性的要求
《预防用疫苗临床可比性研究技术指导原则》(2019年),以体液免疫为主的疫苗,其免疫原性替代终点通常采用接种后免疫应答率(包括抗体阳转率等)和抗体几何平均滴度(GMT)/几何平均浓度(GMC)及其增长倍数。鉴于免疫学理论及检测方法的进展迅速,鼓励同时开展细胞免疫学指标的探索,更全面地反映疫苗诱导的免疫应答反应。
《新型冠状病毒预防用疫苗临床研究技术指导原则》(试行,2020年),对于细胞免疫功能评价,建议检测抗原特异性T细胞反应及相关的细胞因子等。建议考虑的检测指标:特异性T细胞:CD4+、CD8+、Th1、Th2、Th17、Treg细胞亚群;CD3+T细胞、CD20+B细胞和CD16+NK细胞的比例。细胞因子:IL-2、IL-4、IL-5、IL-6、IFN-γ、TNF-α水平。若细胞免疫对于评价疫苗(如病毒载体疫苗、核酸疫苗)的免疫原性具有重要意义,则细胞免疫应作为必需的免疫原性研究内容。病毒载体疫苗、核酸疫苗建议进行细胞免疫的持久性观察。
《新型冠状病毒预防用mRNA疫苗药学研究技术指导原则》(试行,2020年),生物学活性检测应体现疫苗体液免疫和细胞免疫,体内效力试验需根据mRNA疫苗理论的免疫反应原理应评价其体液免疫和/或细胞免疫的生物活性。建议建立检测评价细胞免疫的方法(如利用细胞因子ELISPOT检测评价特异性CTL反应等方法)进行细胞免疫效价的评价。
《肿瘤治疗性疫苗临床试验技术指导原则》(征求意见稿,2022):对于多种抗原组分的肿瘤治疗性疫苗来说,抗肿瘤免疫反应可能涉及多种组分,需要多种检测分析来识别和检测免疫反应的不同组分。常见的检测方法有中和抗体检测、细胞因子检测、四聚体检测、ELISPOT检测等。针对诱导的免疫应答类型(体液免疫或细胞免疫)选择合适的检测方法,建议使用至少两种免疫学检测方法来评估抗肿瘤免疫反应。且建立的检测方法应经过验证,以确保方法的有效性和数据的可靠性。
PART 02
细胞免疫原性检测方法
细胞因子的产生在免疫反应中起重要作用。细胞因子参与许多不同的途径,包括 IFN γ 诱导许多抗病毒蛋白、IL-2 诱导T细胞增殖以及 TNF α 抑制病毒基因表达和复制,此外,细胞因子不是预先形成的因子,而是响应细胞活化而迅速产生和分泌。
酶联免疫斑点技术(enzyme linked immunospot assay, ELISPOT)和基于流式细胞术的胞内细胞因子染色(intracellular cytokine staining,ICS)是评价疫苗诱导的细胞免疫应答最常用的两种检测方法。
表1 疫苗细胞免疫检测方法:ELISPOT和ICS
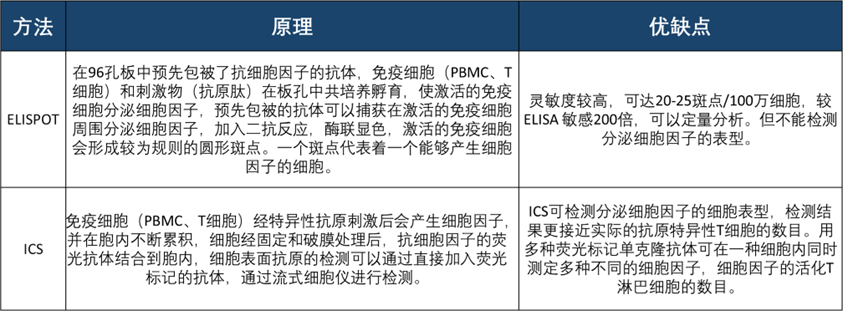
酶联免疫斑点技术(ELISPOT)是细胞免疫研究中最为灵敏的检测方法,可以在单细胞水平对抗体分泌细胞(如B细胞)及细胞因子分泌细胞(如T细胞)进行检测,该方法有极高的灵敏度,可达20-25斑点/100万细胞,并且该方法能够对抗原刺激后的活细胞进行功能性检测,是疫苗领域药效评估的关键检测方法。此外,ELISPOT技术在基因治疗,细胞治疗,抗体/双特异抗体药物等临床生物分析领域得到越来越多的应用。
胞内细胞因子染色(ICS)是一种基于流式细胞术的检测方法,可检测免疫细胞受到刺激后细胞因子的产生和积累。ICS既可以对细胞内表达的细胞因子进行检测,也可以使用细胞表面标志物或MHC多聚体进行免疫表型分析,以检测抗原特异性反应免疫细胞亚群,使其成为一种极其灵活和通用的方法。
PART 03
细胞免疫原性检测的难点和挑战
用于细胞免疫评估的样品为PBMC,在非临床研究中,考虑到采血量的限制通常取实验动物的脾脏和淋巴结组织后直接进行PBMC的分离,而在临床研究中,需要采集外周血后进行PBMC的分离。
PBMC的活性和功能对细胞免疫原性检测结果的准确性至关重要,临床中心采集外周血后到分离PBMC的时长、提取方式、冻存方式、运输条件、解冻和复苏步骤等环节均可能会影响到PBMC的活性,并进一步影响后续试验结果的评估。因此,细胞免疫原性检测前需要规范化PBMC的处理方式,在保留较大提取收率的同时,也要有效维持PBMC的活性和功能。
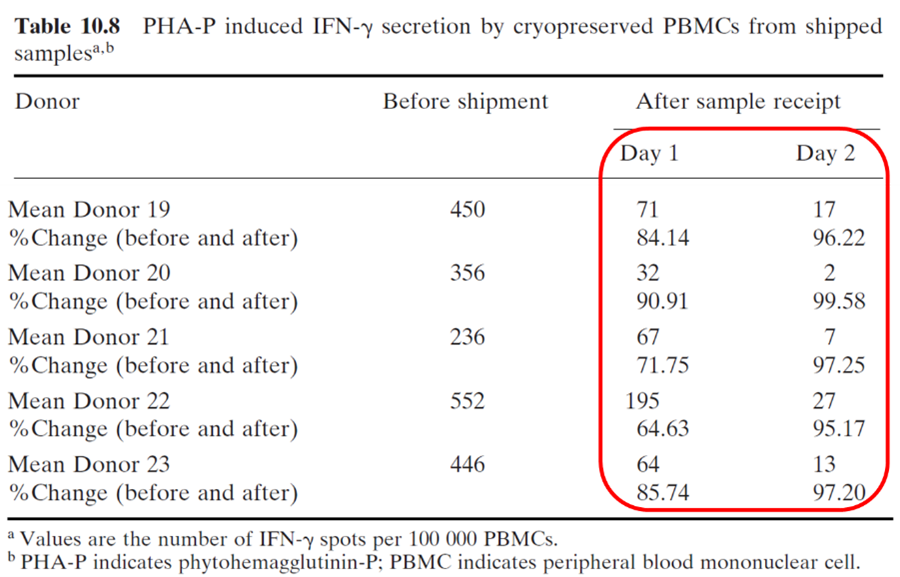
图1 全血放置24h和48h会显著影响PBMC活性以及特异性的细胞因子分泌 [20]
通常情况下需要在全血采集后的8小时内完成PBMC分离,PBMC的活性才能有效的保留。有研究显示,全血放置24h和48h会极大的显著影响PBMC活性以及由抗原刺激诱导的细胞因子分泌。
在进行疫苗临床的细胞免疫原性评价时,首先推荐在临床医院采集新鲜的外周血后直接进行PBMC的分离,即采即分,而后进行检测或放置液氮进行长期保存,然而,临床医院通常不具备分离PBMC分离的环境、设备或人员操作,在疫苗大规模、多中心临床研究中也无法做到操作统一和分离出来的PBMC质量统一。其次,可以在临床医院采集外周血后在一定的时间内运输至中心实验室统一进行PBMC的分离和检测,并对从全血采集到PBMC分离的放置时长进行系统的验证,然而,对PBMC活性,运输时效性、物流费用等临床运营均造成极大的挑战。
PART 04
熙宁生物|精翰生物全血稳定剂,助力疫苗临床细胞免疫原性临床检测
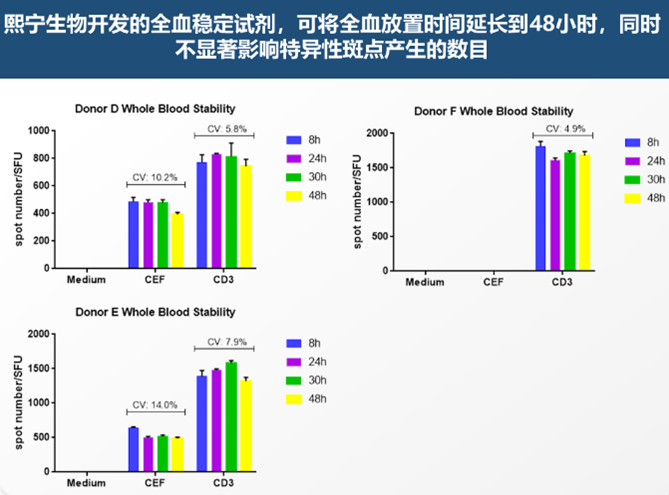
图2 熙宁生物|精翰生物全血稳定剂可将全血分离PBMC前放置时间延长至48小时
基于PBMC为研究对象极大了限制地疫苗的临床细胞免疫原性研究。基于疫苗的临床试验中全血采集后稳定性时长较短的难点,熙宁生物|精翰生物自主研发了一款全血稳定剂,并经过全血保存/分离条件的探索和验证,可将全血分离PBMC前的保存时间延长至48小时,如图所示,ELISPOT检测细胞因子分泌结果无显著的变化,同时,PBMC放置液氮冻存6个月稳定。
此外,由于PBMC稳定性较差,且免疫背景较为复杂,使得ELISPOT/ICS的检测结果的解析变得极为复杂,甚至很多时候检测结果本身也有失真的风险,因此,基于对方法和作用机理的充分理解,熙宁生物|精翰生物通过合理的样品分组设计,方法学验证参数,以及建立完善的数据汇报体系,会对每一个临床样品的检测数据进行解读,充分保证数据的真是可靠。

图3 熙宁生物|精翰生物细胞免疫原性评估和全流程管理
PART 05
结语
熙宁生物|精翰生物具备完善的细胞免疫研究(ELISPOT和ICS)解决方案和数据汇报体系,自主开发的全血稳定剂可解决疫苗细胞免疫研究临床运营痛点,在大样本项目的管理方面拥有丰富的经验,可提供完善的中心实验室服务。
与此同时,熙宁生物|精翰生物具有丰富的疫苗研究和抗传染病领域研究经验,具有完备的生物分析服务平台,支持临床和临床前研究,可实现基于配体结合实验的结合抗体检测,基于活病毒或报告基因的中和抗体检测,基于ELISPOT和ICS的细胞免疫检测,以及基于PCR的病毒分型和载量的检测,覆盖呼吸道合胞病毒、水痘-带状疱疹病毒、人乳头瘤病毒、流感病毒、破伤风毒素、乙肝病毒和治疗性肿瘤疫苗等研究领域。未来,熙宁生物|精翰生物仍将根据临床试验需求继续开发更加准确、灵敏、快捷以及解决临床运营痛点的检测方法和解决方案,助力疫苗和抗传染病领域临床研究。
参考文献 :
[1] Immunological mechanisms of vaccine-induced protection against COVID-19 in humans.
[2] A guide to vaccinology from basic principles to new developments.
[3] Cell-mediated immunity and the challenges for vaccine development.
[4] Reduction and functional exhaustion of T cells in patients with coronavirus disease 2019 (COVID-19).
[5] Deep immune profiling of COVID-19 patients reveals distinct immunotypes with therapeutic implications.
[6] Recruitment of highly cytotoxic CD8+ T cell receptors in mild SARS-CoV-2 infection.
[7] 新型冠状病毒T细胞免疫的人群特征
[8] Virus-specific memory CD8 T cells provide substantial protection from lethal severe acute respiratory syndrome coronavirus infection.
[9] T-cell responses and therapies against SARS-CoV-2 infection.
[10] Targets of T cell responses to SARS-CoV-2 coronavirus in humans with COVID-19 disease and unexposed individuals.
[11] SARS-CoV-2-derived peptides define heterologous and COVID-19-induced T cell recognition.
[12] Robust T cell Immunity in convalescent individuals with asymptomatic or mild COVID-19.
[13] The T cell immune response against SARS-CoV-2.
[14] Immune Responses to Varicella-Zoster Virus Vaccines.
[15] 水痘-带状疱疹病毒的病原学及其相关疫苗的研究进展.
[16] Immune Responses to a Recombinant Glycoprotein E Herpes Zoster Vaccine in Adults Aged 50 Years or Older.
[17] Immunogenicity of the Adjuvanted Recombinant Zoster Vaccine Persistence and Anamnestic Response to Additional Doses Administered 10 Years After Primary Vaccination.
[18] Long-term Protection Against Herpes Zoster by the Adjuvanted Recombinant Zoster Vaccine Interim Efficacy, Immunogenicity, and Safety Results up to 10 Years After Initial Vaccination.
[19] https://www.modernatx.com.
[20] Validation of Cell-Based Assays in the GLP Setting-VALIDATION OF THE IFN-γ ELISPOT ASSAY