



前言
随着CTLA4抗体药物,PD1抗体药物, CD3-CD19双抗blinatumomab,CD3-CD20双抗Mosunetuzumab等相继获批上市,适应症不断的拓宽,免疫治疗在新药研发领域深入人心。新的免疫调节剂靶点和免疫调节剂分子实体进入药物研发阶段,在关注其极佳的药效学前景的同时,也需要要考虑其安全性风险。免疫调节剂,特别是免疫激动剂,CD3 based多特异抗体均属于临床高风险产品,对于此类产品IND申报前,CDE发布最新版本的《药物免疫原性研究技术指导原则》指出,完整的非临床评价需要整合所有可用的体内和体外试验数据。除了在常规的动物体内毒性试验中进行细胞因子相关检测外,还应进行体外细胞因子释放试验。当体内试验结果为阴性时,体外试验阳性结果可以提示潜在临床安全风险。体外细胞因子释放试验该如何做?得到的数据该如何解读?对于首次人体临床剂量的选择有何指导意义?笔者将通过TGN1412引发的灾难性的临床事件以及原因探寻,英国NIBSC 组织国际著名药企的能力测评,以及熙宁的体外细胞因子释放试验检测实践三方面对体外细胞因子释放试验进行介绍说明。
起源:CD28激动剂TGN1412临床事件以及原因探寻
TGN1412是一款靶向T细胞的共刺激受体CD28的超级激动剂,在2006年该抗体第一次进入人体临床实验时,6个健康的受试者在注射该抗体的90分钟之内便产生了严重的危机生命安全的细胞因子风暴。开发该抗体的公司TeGenero Immuno Therapeutics也在一年后宣布破产。事后的分析确认用于临床实验抗体的成品是符合标准规范的,尤其是排除了可能引起细胞因子风暴成因的内毒素的污染。这说明在临床前研发阶段TGN1412的免疫毒性实验结果对人体内的安全性预测失败。这些临床前的实验包括体外试验评估,即体外人和其他物种的PBMC/全血细胞进行细胞因子释放的测定,也包括体内试验评估,即亲缘相近的灵长类哺乳动物食蟹猴的体内实验测定细胞因子释放。
关于TGN1412临床前研发阶段的体内和体外免疫毒性实验结果对人体内的安全性预测的失败原因的探寻,笔者认为医药研发行业和监管机构得到了两个非常有价值的结论。
第一个是,对于免疫激动剂,在进行临床前动物实验时,需要对动物进行是相关性界定,采用不相关性动物模型进行免疫激动剂的药理毒理评估将会重新走上TGN1412的悲剧道路,是需要极力避免的。如图1,以下是笔者对于相关性动物的理解:
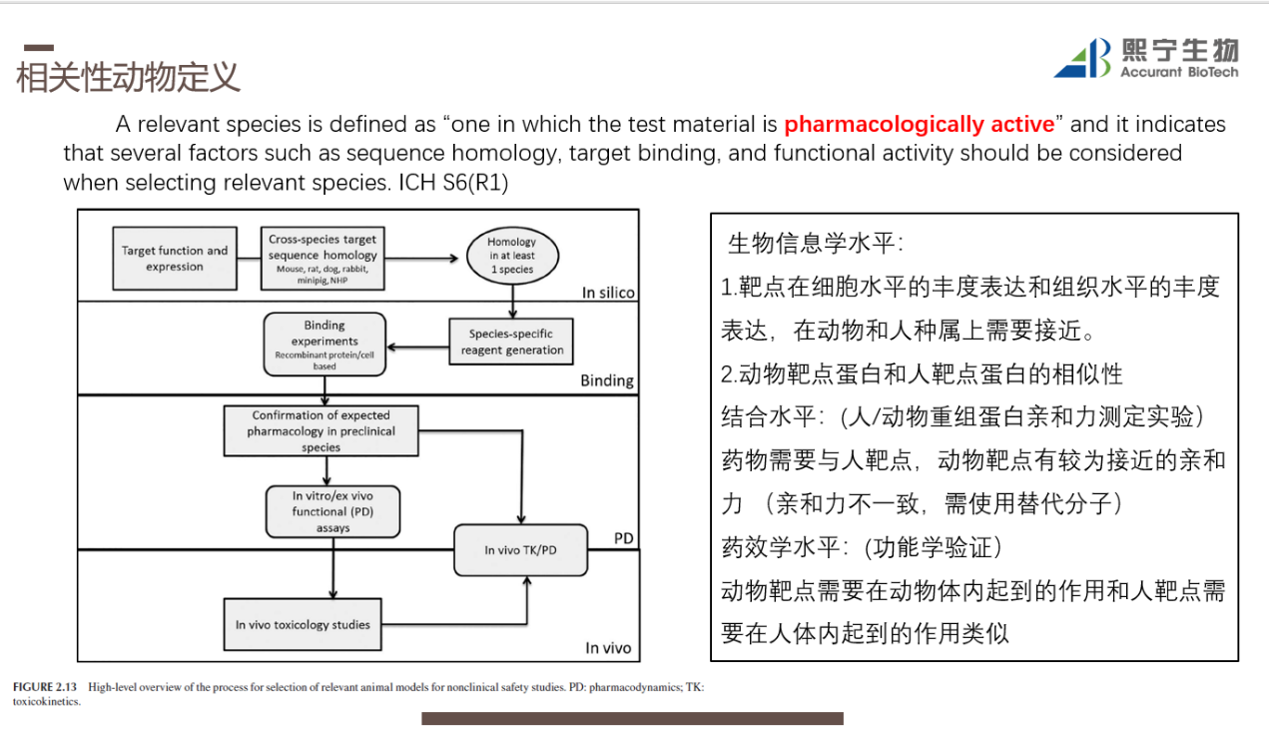
图1:相关性动物界定
与非人灵长类动物(NHPs)相比,人类T细胞通过T细胞受体激活后,具有更强的增殖反应。具体的原因可能是相对于非人灵长类动物,人的CD33相关的siglec糖蛋白有明显的下调。CD33-siglec糖蛋白轴具备抑制T细胞激活的重要调节功能。基于此点,免疫调节剂使用非人灵长类动物(NHPs)进行临床前体内的免疫毒性评估,均有低估其免疫毒性的风险。
第二个是对于免疫调节剂,体外细胞因子释放试验该如何进行设计和试验,才能有效的预测或者外推到首次进入人体的安全剂量。关于此点英国NIBSC (National Institute for Biological Standards and Control)组织采用更加相关性的人PBMC设计了6种TGN1412和人PBMC刺激作用模型,如图2。实验结果表明TGN1412上临床前的两种体外实验方案(1,2)并不能很好模拟人体内TGN1412和与人免疫细胞的相互作用。体外和体内结果的回顾性比较显示,体外的4,5,6三种实验方案(固-液作用模式,合适足够的TGN1412剂量)可能更加贴近体内TGN1412与人免疫细胞的作用模式。
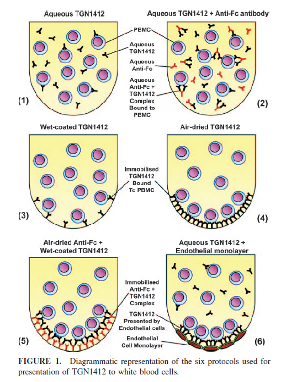
图2: TGN1412体外试验的6种模型
笔者认为基于免疫调节剂调动人体免疫系统的复杂的相互作用,需要我们对单一目的的体外细胞因子释放试验实验进行多样化实验条件的设计,安全性测定要做全的同时,也要做多,做到细致,同时对于检测数据要有专业化的解读。
标准化:英国NIBSC组织国际大药企进行的体外细胞因子释放试验能力测评

体外细胞因子释放试验该如何做?结果的可信度怎么样?NIBSC在2020年组织了国际上知名大药企,包括Amgen, Pfizer, Roche,GSK,BMS等共同进行了一次能力测评和国际协作研究,并选定了CD3抗体OKT3, CD28抗体TGN1412, CD52抗体Campath-1H作为测评的阳性药物,值得业界同仁借鉴学习,如图3,以下是笔者对于试验模式的总结:
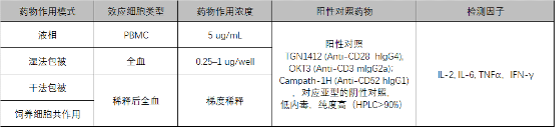
图3:NIBSC免疫调节剂体外细胞因子试验模型要素
各大药企基本达成了共识,即应该采用多种药物作用模式进行免疫调节剂的体外细胞因子释放试验,但是各大药企采用的模式通常不完全一样,如何确保其采用的模式能够达到预期体内安全性风险的目的,得到可信赖的结果,使用一个可信的阳性对照和阴性对照来确保检测平台检测结果的可靠性显得极为重要。由于采用个体的全血和PBMC进行测定,检测结果通常会存在个体差异,检测结果有较大的波动范围,汇集了多个药企采集了接近100个个体的检测数据范围将是一个很好的判断体外细胞因子释放试验结果是否可靠参考标准,如下图4所示,采用固相作用模式检测阳性对照对PBMC刺激作用的体外细胞因子释放各细胞因子的检测结果如下:
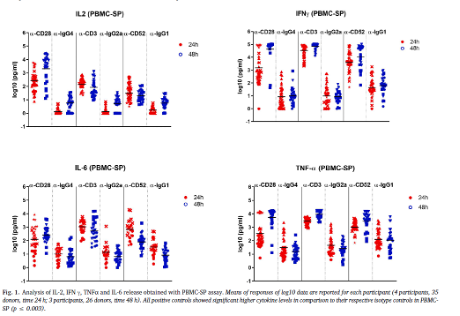
图4:体外细胞因子试验NIBSC披露的数据
方案设计和数据分析:熙宁生物体外细胞因子释放试验实践
免疫调节剂的临床前体外细胞因子释放需要基于药物的作用机理进行方案的设计,需要尽可能用体外的方法来模拟体内药物和免疫细胞的作用模式,这是体外方法能够有效预测体内情况的基础。由于免疫系统互作的复杂性,不同免疫调节剂的作用机理并不相同,一个尽可能全面考虑不同药物作用模式的实验方案设计是得到有效数据和进行数据分析的基础。熙宁生物基于对体外细胞因子释放试验的深刻认知,结合相关文献报道分析,推荐的体外细胞因子释放试验模型和变量如下:

图5:熙宁推荐的免疫调节剂体外细胞因子试验模型要素
1.药物作用模式使用液相,湿法包被和干法包被,可以对药物作用于靶点是单价起效,多价起效,或者Cross-link模式多聚态起效等药物作用模式进行全面表征。
2.效应细胞至少包括PBMC和全血,可考虑稀释后全血,全血作为效应细胞更加贴近真实的生理情况,但是对免疫调节剂的刺激会比较钝化;PBMC作为效应细胞对于免疫调节剂的刺激会比较敏感,通常会得到阳性的数据,稀释后的全血通常情况下对于免疫免疫调节剂的刺激敏感度是介于全血和PBMC之间。
3.药物作用测定浓度选择在0.25ug/mL-10ug/mL,大致类比于体内的药物浓度12.5ug/KG-500ug/KG, 可根据药物计划的剂量进行进一步调整。
4.阳性对照选择CD28抗体TGN1412和CD3抗体OKT3,两者在临床试验中证实有较强的免疫因子释放,并且两者对免疫系统的刺激的作用机理并不完全相同,可以用于评估不同的药物作用模式的异同。
5.细胞因子根据《药物免疫原性研究技术指导原则》检测IL-2, IL-6, TNFα,IFN-γ,IL10,可采用MSD进行多因子检测,或者性价比较高使用ELISA进行检测。
6.至少进行三个受试者进行测试,每个受试者均进行全血和PBMC的检测。
熙宁生物有丰富临床免疫细胞药效学检测经验和临床前的体外细胞因子释放试验,根据上述方案设计,进行多样化的药物作用模式,使用阳性对照CD28抗体TGN1412和CD3抗体OKT3进行测试,部分检测结果如图6,如IL2的分泌情况如下:

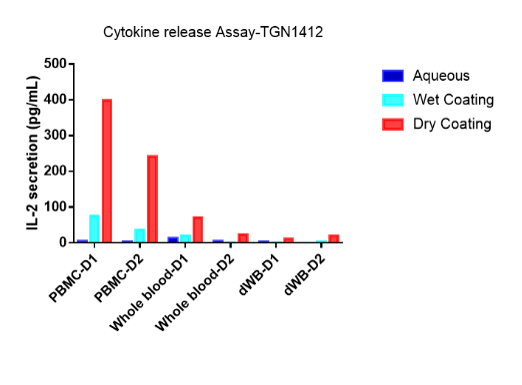
图6:体外细胞因子试验熙宁得到的部分数据
上述检测结果和NIBSC披露出来的数据具备高度一致性,从试验结果也能得出以下的观点:
1.多种体外试验模型在同一种免疫调节剂中,细胞因子释放的强度差异非常明显。
2.不同的免疫调节剂在用一种体外试验模型模型中,细胞因子的释放强度差异明显。
3.同一种免疫调节机在不同的体外刺激模型中,细胞因子的释放强度差异明显。
不同的免疫调节剂在不同的体外试验模型中有不同的结果,同时也能得到一些趋势较为一致的结果,即
1.PBMC作为效应细胞相对于全血有较强的刺激效果
2.包被相对于液相有较强的刺激效果
3.干法包被相对于湿法包被相,在CD28抗体TGN1412中有更强的刺激效果,在CD3抗体OKT3中有较弱的刺激效果,可能跟药物的作用机理相关。
总结讨论:
对于免疫调节剂的临床前试验,特别是免疫激动剂和CD3 Based双抗来说,动物模型往往缺乏相关性,需使用人的PBMC用体外的检测方法有效性评估和安全性评估,作为完整的非临床评价最为重要的一部分,如下图,FDA甚至发文推荐使用人的免疫细胞用体外的检测方法得到的数据作为首次人体用药剂量的最为参考因素。中国CDE发布最新版本的《药物免疫原性研究技术指导原则》指出完整的非临床评价需要整合所有可用的体内和体外试验数据。除了在常规的动物体内毒性试验中进行细胞因子相关检测外,还应进行体外细胞因子释放试验。当体内试验结果为阴性时,体外试验阳性结果可以提示潜在临床安全风险。

图7:FDA推荐使用体外试验数据用于免疫激动剂的首次人体用量外推
体外细胞因子释放试验由于免疫调节剂作用机理的复杂性,试验设计需要有多样化的技术方案,体外细胞因子释放试验必须要做,如何做才算完整,得到的数据如何解读,并对免疫调节剂的首次临床剂量选择起到怎样的指导作用,这都需要有专业化的认知和实际经验才能进行把控。熙宁生物有丰富的免疫调节剂IND申报必检项-体外细胞因子释放试验的项目经验,能够提供性价比最高的优质服务,欢迎咨询讨论。
参考资料:
1.Stebbings R,etc. "Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. J Immunol. 2007 Sep 1;179(5):3325-31.
2.Vessillier S, etc. Development of the first reference antibody panel for qualification and validation of cytokine release assay platforms - Report of an international collaborative study. Cytokine X. 2020 Dec;2(4):100042.
3.Harper J,etc. An approved in vitro approach to preclinical safety and efficacy evaluation of engineered T cell receptor anti-CD3 bispecific (ImmTAC) molecules. PLoS One. 2018 Oct 15;13(10):e0205491.
4.Saber H,etc. An FDA oncology analysis of CD3 bispecific constructs and first-in-human dose selection. Regul Toxicol Pharmacol. 2017 Nov;90:144-152.
5.Saber H, etc. An FDA oncology analysis of immune activating products and first-in-human dose selection. Regul Toxicol Pharmacol. 2016 Nov;81:448-456.
6.CDE发布最新版本的《药物免疫原性研究技术指导原则》
7.熙宁生物非临床体外试验评价服务介绍.PPT