



前言
生物疗法已被批准用于许多疾病的治疗。与传统的小分子相比,生物疗法有许多优势,但其有可能诱导生物体产生针对自身的免疫反应,形成抗药物抗体(anti-drug antibodies,,ADA),进而产生各类副作用。中和抗体(Neutralizing antibody,NAb)是一个特殊的ADA亚种群,能够抑制生物药的生物活性从而减弱其药效。考虑到ADA和NAb会严重影响药物使用的有效性和安全性,在抗体药物研发过程中必须要进行免疫原性检测。
基于细胞的功能性NAb试验是一种常用段来检测其中和活性。但是这种检测技术往往容易受到体内药物循环以及来自多种血清因子(包括但不限于生长因子和疾病相关细胞因子)的干扰。因此,酸解磁珠提取法(Bead Extraction with Acid Dissociation,BEAD)被成功创造并应用于从样本中去除循环药物或其他干扰因素,从而富集ADA/NAb。但该技术在萃取过程中使用的强酸会导致NAb发生不可逆变性,从而导致NAb的测量值被低估。为避免这一现象,本次将为大家介绍一种新的技术:热解离磁珠提取法(Bead Extraction with Heat Dissociation,BEHD)。该技术通过利用不同蛋白结构所对应的耐热性不同,来特异性地使药物本身发生不可逆变性,从而使样品中仍存在活性的ADA/NAb免疫复合物被更好地检测到。
BEHD的实验流程
1、将100 μL对照品或样品添加到96孔板内,用封板膜覆盖, 62°C,400 rpm恒温振荡孵育40 - 60分钟。
2、取出96孔板,待冷却约15 min后,加入生物素化药物28 μL(50 μg/mL,用含1% BSA的DPBS稀释),2-8℃,1000 rpm振荡过夜。
3、将包含ADA—生物素化药物的复合物振荡孵育固定在250 μg链霉素亲和素包被的磁珠上。
4、将磁珠吸附复合物用600 μL的 PBST清洗2次,用60 μL的2×RPMI-1640洗脱。
5、将50 μL洗脱液转移到含有22 μL 100 mM HEPES的新的96孔板上。
6、后续操作参考常规实验步骤。
实验结果
1、实验药物和阳性对照的热稳定性
药物和NAb对于温度的耐受差异是BEHD的一个核心问题。因而,本文首先比较了实验药物与多组抗实验药物的NAb PCs(阳性抗体)的热稳定性。如图1A和表1所示,实验药物在62°C几乎都已变性,而大部分NAb PCs在此温度下仍能保持结构的稳定。其中热稳定性最佳的为Rabbit pAb NAb PCs。
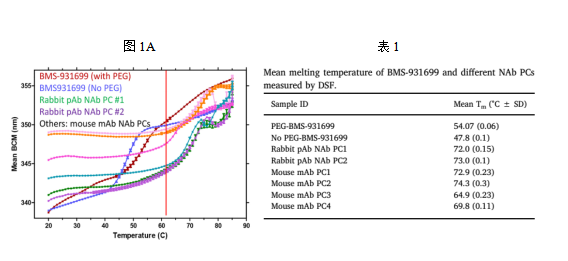
为了进一步确认实验药物和NAb PCs热稳定性的不同,将两者在不同温度下加热50-60 min,然后检测药物和NAb PCs剩余活性。如图1B和1C所示,在62°C的情况下,浓度等于或低于0.5 μg/mL的药物其活性显著降低。相反,不同剂量的NAb PCs在所测试的温度下都保留了活性。
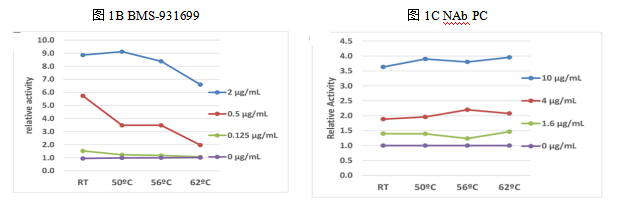
上述结果表明,在62°C下,大多数药物发生了不可逆的变性,而所有检测的NAb PCs仍能保留活性。
2、加热代替酸处理提高抗实验药物 NAb的回收率
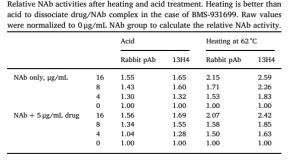
BEHD与BEAD的主要区别在于第一步是对样品进行热处理或酸处理。为了评估热处理与酸处理的效果,作者比较了经两种手段分别处理后的Rabbit pAb Nab PCs的相对活性。如表2所示,62°C加热分解药物/NAb免疫复合物后,NAb的相对活性明显优于酸处理。
那是否是因为这类Rabbit pAb Nab PCs对酸处理过于敏感导致其不适用于酸处理的方法呢?因此,作者设计了一种在较低pH环境下能保持更高活性的PC——13H4。从表2可知,13H4在两种处理下的表现也如同之前的PCs一样。这表明相较于酸处理,热处理更能保持NAb的相对活性,提高其回收率。
表2
结论
随着生物药物结构、作用位点的不断创新,许多ADA/NAb阳性抗体不能承受苛刻的酸处理,这直接导致了ADA/NAb回收率低,例如有聚乙二醇化结构域的抗体就不耐受低pH的环境。因此创造一种不基于“酸处理”的方法显得十分重要。在本文中,作者也验证了热解离磁珠提取法(BEHD)法具有良好的耐药性、精密度和灵敏度,可应用于免疫安全性检测实验中。然而,该方法也存在一定局限性。此方法的前提是实验室需具备特殊仪器用于检测相关蛋白的耐热情况。并且,它只适用于ADA/NAb阳性抗体的耐热性高于药物蛋白本身的实验方法。
同时,该方法跳出常规实验思路,从蛋白的基本物理性质层面去优化实验步骤,也为我们之后的方法开发提供了一个新角度。
参考文献
1.Bead-extraction and heat-dissociation (BEHD): A novel way to overcome drug and matrix interference in immunogenicity testing. Journal of immunological methods, 2018, 462, 34–41.
2.Integrated pharmacokinetic/pharmacodynamic analysis for determining the minimal anticipated biological effect level of a novel anti-CD28 receptor antagonist BMS-931699. J. Pharmacol. Exp. Ther, 2015, 355 (3), 506–515.
3.Development and characterization of a pre-treatment procedure to eliminate human monoclonal antibody therapeutic drug and matrix interference in cell-based functional neutralizing antibody assays. J. Immunol. Methods, 2015 416, 94–104.
4.Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. J. Pharm. Biomed. Anal, 2008, 48 (5), 1267–1281.
5.Advances in the treatment of cutaneous lupus erythematosus. Lupus, 2016, 25 (8), 830–837.
6.Pure red-cell aplasia and antierythropoietin antibodies in patients treated with recombinant erythropoietin. N. Engl. J. Med,2002, 346 (7), 469–475.
7.A bioactive drug quantitation based approach for the detection of anti-drug neutralizing antibodies in human serum. J.Immunol. Methods, 2009, 345 (1–2), 70–79.