



PART 01
诺贝尔生理学医学奖microRNA
2024年诺贝尔生理学医学奖授予科学家维克托·安布罗斯(Victor Ambros)和加里·鲁夫昆(Gary Ruvkun),以表彰他们发现了微小RNA(microRNA)及其在转录后基因调控中的作用。这不仅是对microRNA在生物学基础研究中的重要性的认可,更为药物研发和临床应用带来了新的机遇。
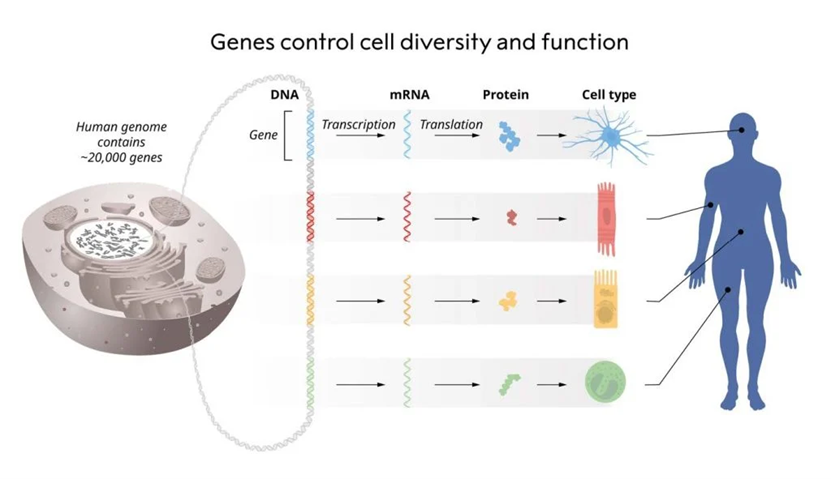
图1 遗传信息从DNA到mRNA再到蛋白质的流动
要理解这项发现的重要性,我们需要先了解生物体内基因表达的基本过程。RNA作为中心法则的重要组成部分,起着承上启下的作用。它不仅是遗传信息传递的桥梁,也是基因表达调控的重要参与者。在细胞内,RNA负责将存储在DNA中的遗传信息转录为可用于合成蛋白质的信使RNA,并通过翻译转化为具有生物功能的蛋白质。这一过程使得细胞能够精确地响应内外部环境的变化,从而保持生命活动的正常进行。
microRNA是一类很短的RNA分子,通常只有20~24个核苷酸长。这些微小分子不产生蛋白质,而是通过影响其他 RNA分子来调节基因的活动。上世纪80年代,Ambros和 Ruvkun在研究线虫生长相关的生理学机制时,偶然发现lin-4 基因产生的一小段microRNA,就像一个微型密码,而这个密码恰好能部分匹配lin-14基因末端的一些重复片段,当两个分子相结合,就会阻止lin-14产生蛋白质。
然而,这个发现一开始并没有引起太多关注。直到2000 年,Ruvkun 的实验室发现了名为let-7的第二个microRNA。let-7不仅存在于线虫中,还在人类和其他动物中被发现,这意味着microRNA调控机制在动植物界具有普遍性,由此引起了科研界的深度重视与广泛研究。
PART 02
RNA的分类及功能
随着科学技术的进步,RNA的研究也不断深化。高通量测序技术的发展使得研究人员能够全面分析细胞内的RNA组成,揭示不同细胞类型和状态下的转录组特征。RNA根据是否编码蛋白质可以分为编码RNA(coding RNA)与非编码RNA(non-coding RNA)。

编码RNA(coding RNA)
编码RNA即我们常知的mRNA,负责将DNA中的遗传信息转录为蛋白质。mRNA在细胞核中合成后,经过一系列的加工和修饰(如加上5'帽和3'聚腺苷酸尾)后转运到细胞质中,供翻译使用。
mRNA转录组测序通过比较不同组织类型、发育阶段或处理条件下的转录组,揭示基因表达的动态变化。分析基因的表达水平可以揭示疾病相关的基因表达变化,帮助药企与研究人员深入理解疾病机制,优化药物疗效和安全性。

非编码RNA(non-coding RNA)
非编码RNA(non-coding RNA)通过多种机制互相作用,共同调控基因表达的各个阶段。它们不仅影响转录后过程,还参与细胞内信号传导、代谢调节和细胞周期等重要生物过程。
除tRNA与rRNA外,其他非编码RNA如微小RNA(microRNA)可以通过结合到目标mRNA上,抑制其翻译或导致其降解,从而调节特定基因的表达水平;长链非编码RNA (lncRNA)则通过与DNA、RNA或蛋白质相互作用,调节基因的转录和其他细胞过程;环状RNA (circle RNA)以环状结构存在,通常由内含子剪接产生,吸附并抑制特定microRNA的功能,从而调节microRNA靶基因的表达;小干扰RNA (siRNA)是一类双链小RNA,参与RNA干扰(RNAi)机制,通过降解特定mRNA来沉默基因表达;小核RNA(snRNA)主要存在于细胞核内,参与mRNA前体的剪接及其他RNA加工过程;小核仁RNA(snoRNA)主要位于核仁中,参与rRNA的化学修饰和加工等等。这些非编码RNA的发现不仅丰富了中心法则的内涵,还为理解基因调控的复杂性提供了新视角。
非编码RNA转录组测序正日益成为推动药物研发和精准医疗的重要工具。通过非编码RNA转录组测序,药企能够识别与特定疾病相关的非编码RNA,从而发现新的药物靶点;由于非编码RNA在体液中(如血液和尿液)相对稳定,其表达水平也可以用于早期诊断和疾病预后评估;通过对特定非编码RNA的功能研究,能够揭示其在疾病发生过程中的作用,不仅有助于深入理解疾病的分子机制,还可以为开发新型治疗策略提供理论依据;例如,lncRNA通过调控基因的转录或参与染色质重塑,影响细胞增殖、分化和凋亡等过程。通过监测特定非编码RNA的表达变化,研究人员能够判断药物是否有效,并识别潜在的副作用。这种实时的监测手段有助于优化治疗方案,最大限度地提高药物的疗效和安全性。
PART 03
实验端检测:RNA-Seq建库流程

图2 熙宁|精翰转录组测序实验技术路线
以mRNA建库为例,总RNA抽提后需要测定浓度和纯度,同时由于RNA容易降解,需要通过电泳测定RNA的完整度。
总RNA中含有大量的核糖体 RNA (rRNA),约占总RNA 80-98%。对绝大多数 RNA-Seq 应用来说,需要去除 rRNA 或捕获mRNA,从而保证测序数据集中在转录组所需的部分并节省成本。mRNA的富集通常有两种方式,Poly(A)捕获使用Oligo(dT) 分子杂交mRNA的Poly(A)尾从而实现mRNA的富集。poly(A) 富集需要高质量的 RNA,如果是放置时间长的组织样本,RNA可能降解断裂,同时由于对 poly(A) 尾的选择,3' 端被富集,而5' 序列容易丢失,因此Poly(A)捕获常存在捕获效率低和偏好性的问题。
熙宁生物|精翰生物采用rRNA去除的方法,rRNA去除原理是通过互补DNA寡核苷酸杂交和RNA酶H消化,去除与DNA寡核苷酸双链化的rRNA和珠蛋白mRNA(mRNA中珠蛋白mRNA约占30%-70%),然后进行DNA酶处理以清除DNA寡核苷酸。rRNA去除的方法效率更高,可以保留更丰富的mRNA分子。
随后经过片段化和逆转录合成DNA,再经过加A和接头连接,以及扩增和纯化,即完成建库。由于DNA的两条链均可以作为模板转录mRNA,如果无法区分模板的来源则会发生干扰。熙宁生物|精翰生物采用链特异性建库,保留了转录本的方向信息,可区分转录本的来源,避免了互补链的干扰。
PART 04
生信端分析:转录组测序数据分析
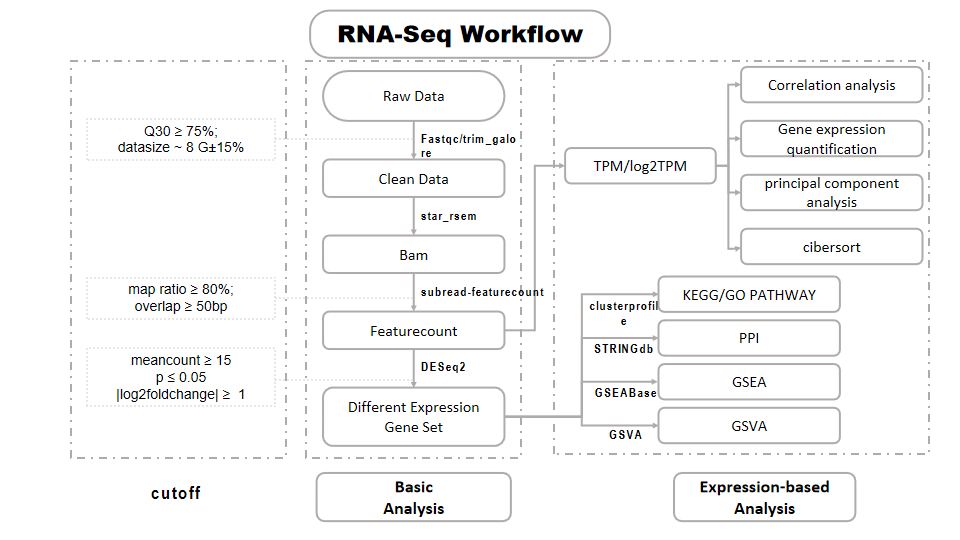
图3 熙宁|精翰转录组测序生信分析流程
熙宁生物|精翰生物的转录组测序生信分析流程包括多个关键步骤,以确保数据的高质量和准确性。首先,进行数据预处理,涵盖数据拆分、测序元件序列去除、质量控制和过滤,以及质量指标统计。经过质控的数据将被比对至参考基因组,统计比对率和测序深度等指标。根据基因组特征,统计每个基因的表达丰度(RC,Read Count)并进行基因注释,可视化基因的表达水平,进行样本相关性分析及主成分分析,并针对有重复样本和任意分组的无重复样本进行差异基因分析与差异基因功能富集分析。转录组测序的高级分析包括蛋白网络分析、基因集差异分析、基因集富集分析、免疫浸润分析等。合并统计多个样本的质控信息进行综合分析和展示。通过这一系统流程,为客户提供全面而深入的转录组测序数据分析服务。
部分结果展示:
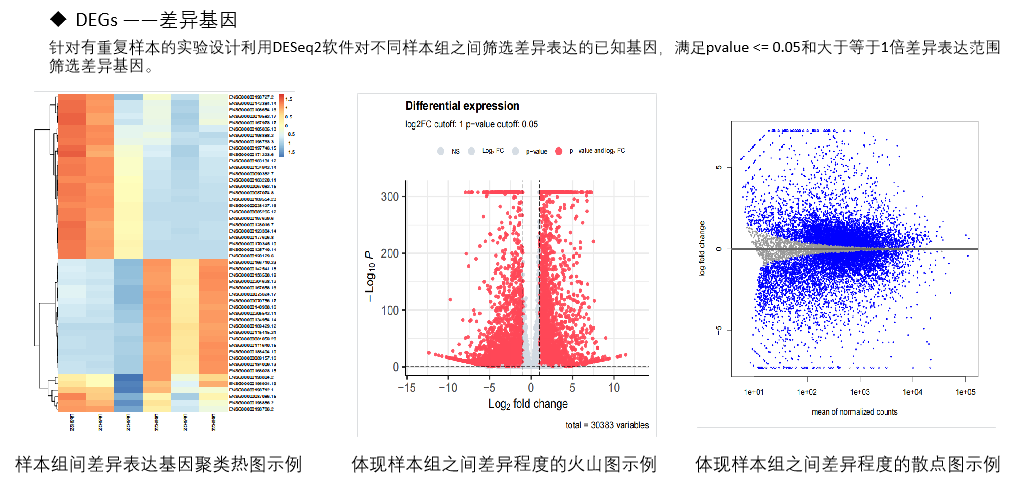
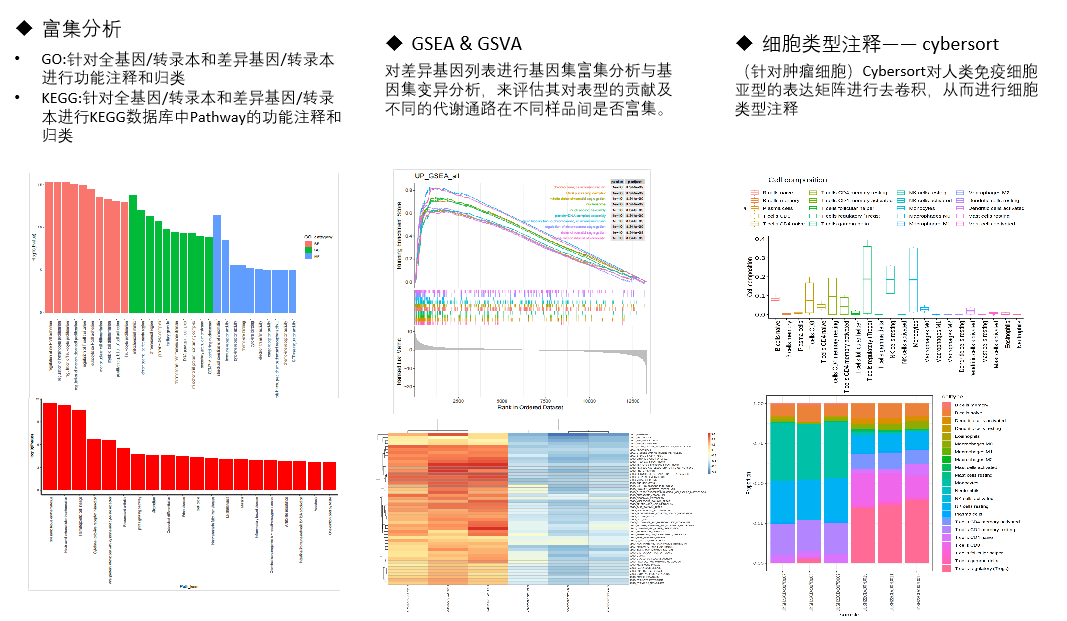
图4 熙宁|精翰转录组测序生信分析结果部分展示
PART 05
熙宁|精翰生物RNA-Seq检测服务
在生物医学研究和药物开发的前沿,熙宁生物|精翰生物转录组测序服务已完成分析性能验证,可全面分析组织、血液、石蜡包埋切片等样本的mRNA表达情况,采用Roche KAPA试剂进行rRNA去除和链特异性文库构建,保证文库质量和数据的稳定性,使用Illumina测序仪完成上机测序。生信流程覆盖基因差异表达分析、差异基因功能和通路注释等,最终出具完整全面的实验结果报告,可在5~8个工作日内完成样本分析全流程,助力申办方开展药物作用机制研究和生物标志物研究。