



依据ICH S9 抗肿瘤药物非临床评价的指导原则,通常采用啮齿动物的STD10的1/10或者非啮齿动物的HNSTD的1/6,经动物和人的种属转换后作为起始剂量用于临床一期药物剂量设计。该技术路径有较多的限定条件,比如需要论证动物是相关动物种属,不适用于免疫激动特性药物等。大小动物毒理驱动的临床一期药物起始剂量设计的滥用会提升药物首次进入人体的安全性风险,降低一期剂量递增时研究效率。如ICH S9所描述起始剂量应采用所有已有的非临床数据(例如药代动力学、药效学和毒性)进行科学论证,并且基于多种方法进行选择。在非临床阶段,引入药效学数据,特别是基于人来源相关基质的药效学数据作为选择之一,是药物研发从化疗药物进入靶向药物,从单一作用机理到复杂作用机理,从简单分子实体到复杂分子实体更加合理的技术路径,也是更加具备科学依据的选择。
PART 01
临床一期药物剂量设计技术路径
在药物研发的进程中,转化医学的一个重点研究方向必然包含以下三个问题:
➢
体外试验有效/安全,为什么体内试验无效/不安全?
➢
体内动物试验有效/安全,为什么人体试验无效/不完全?
➢
如何从体外数据,动物数据能够较为准确的外推/预测到在人体的安全性和有效性?
关于以上三个问题的研究会贯穿于整个药物研发的进程,也是提升临床药物研发效率的最为关键的因素。笔者从临床一期设计所需的非临床试验和数据尝试回答以上三个转化医学的问题。
如下图1A所示,依据ICH S9 抗肿瘤药物非临床评价的指导原则,通常采用啮齿动物的STD10的1/10或者非啮齿动物的HNSTD的1/6,经动物和人的种属剂量转换后可作为起始剂量用于临床一期药物剂量设计[1]。该技术路径是监管需要,GLP毒理必需要做的内容,且检测模型非常标准化,也是目前绝大多药物所采纳一期药物剂量设计的依据。
下图1B所示,基于动物模型对候选药物进行药理药效评估,基于药效学结果,经动物和人的种属剂量转换后外推到人体的最小起效剂量,结合毒理的最大起始剂量综合对临床一期的剂量设计。
1A和1B两种评估方式建立的前提是相关动物种属,相关动物种属的概念有比较重要的内涵,且是需要有试验数据支撑,这点往往会被忽略,比如动物的靶点蛋白组织表达水平和人体表达水平是否一致,药物对动物靶点蛋白的效果(如亲和力)和人体靶点蛋白的效果(如亲和力)是否一致,在这些问题没有弄清楚前直接采用动物毒理的数据用于临床一期药物剂量设计是缺乏科学性的。CD28的超级激动剂TGN1412依据毒理数据决定临床一期起始剂量在人体试验中的悲剧后果(受试者发生剧烈的细胞因子释放,均进了ICU)是非相关动物模型的典型案例[2]。
如图1C所示,ICH S9也有推荐对于免疫激动类药物,采用人来源的基质使用体外方法建立药效学模型,以最小起效剂量(如EC20)换算成人体血药浓度后作为最小起效剂量用于一期临床剂量设计,该技术路径越来越具备科学性和先进性。人来源基质取自于人,没有非相关性动物模型的困扰;同时来自于人体的基质环境也会影响到药物在人体的效果(如血浆蛋白结合率的影响),全血/血浆基质的药效学反应能够更好的预测药物进入人体的反应。人来源全血/血浆/PBMC的药效学模型,是极佳的转化医学研究模型,可以回答上述转化医学问题。
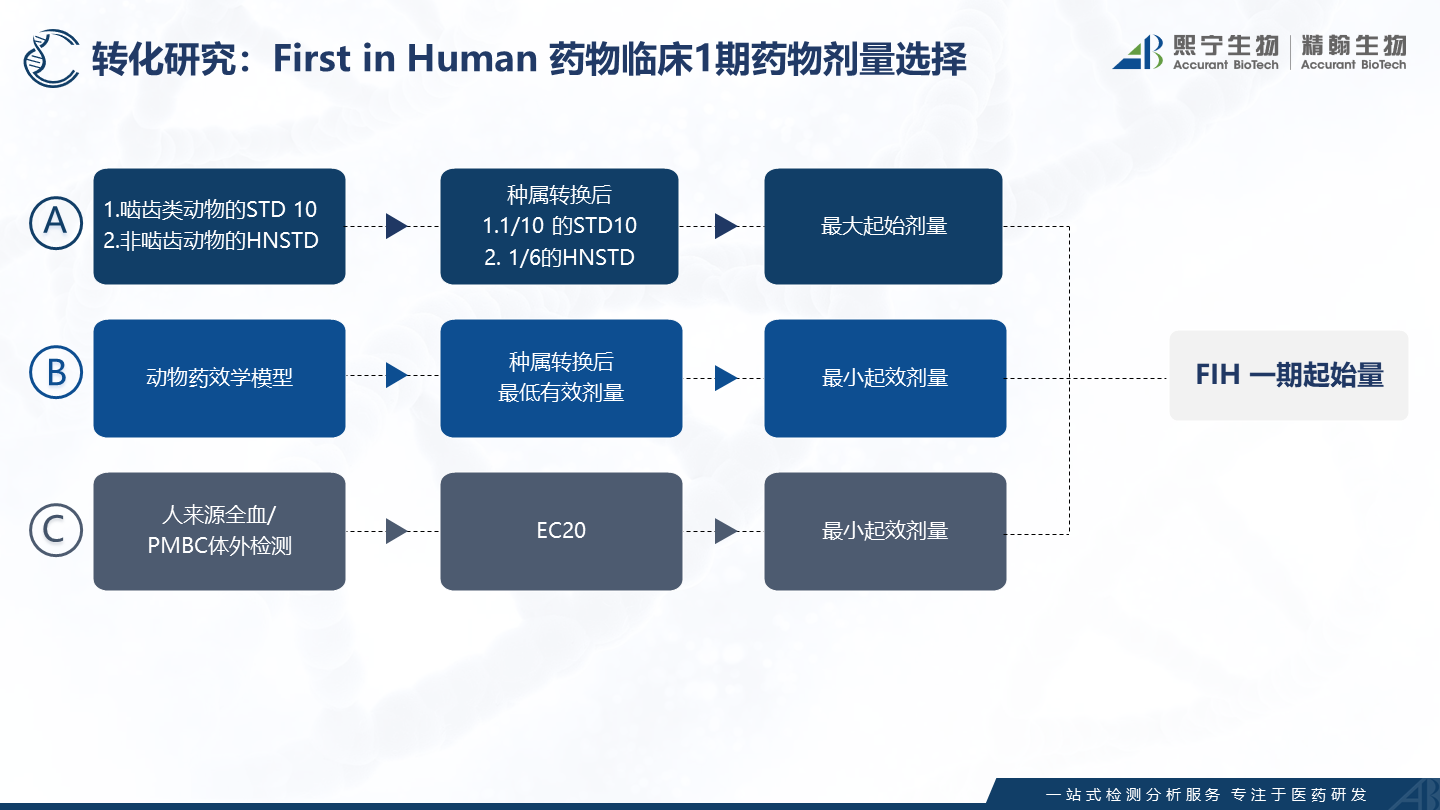
图1 FIH临床一期药物剂量设计的三条路径
PART 02
人来源基质的非临床药效学研究

首个TCR疗法Tebentafusp的体外药效学评估
Tebentafusp为首个FDA获批的TCR疗法,其为CD3 based双特异蛋白,靶向gp100特性多肽HLA-A*02:01复合物。由于人免疫系统特异性,很难找到相关性动物模型,Tebentafusp的临床前研究以及用于首次人体的一期剂量设计采用的是一系列的来自人体全血/PBMC的体外试验进行有效性,安全性和特异性评估[3]。
如下图2 Immunocore和Adaptimmune的 科学家介绍了在有效性,安全性和特异性方面进行评价临床前的体外方法的测试项。
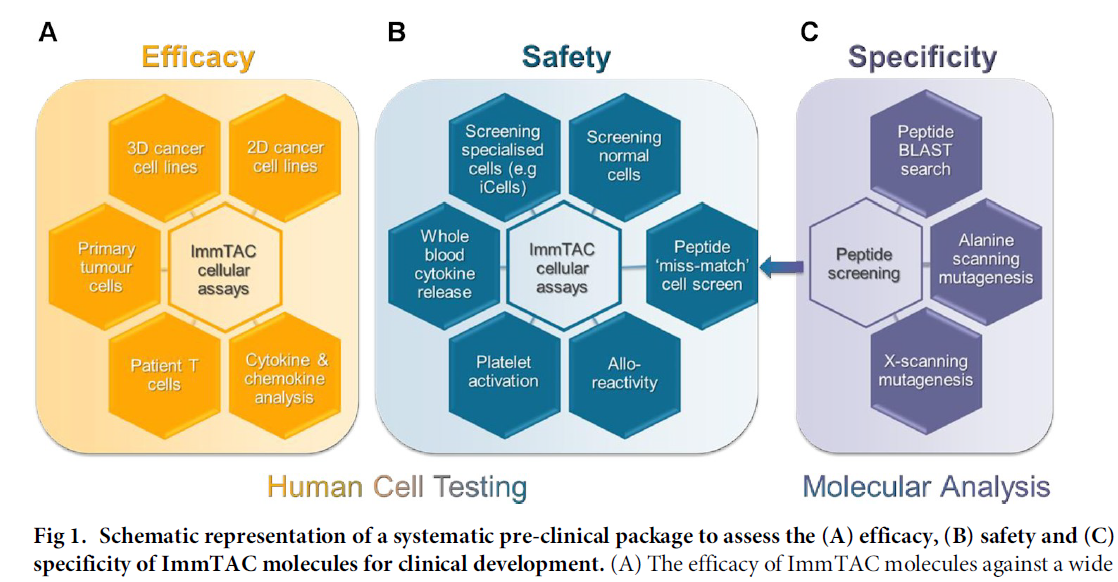
图2 Tebentafusp一系列来自于人全血基质的体外试验
其中有效性评估-体外人T细胞激活和杀伤,使用的方法分析:
➢
基于人PBMC Tebentafusp介导特异性的肿瘤细胞杀伤试验,采用的是LDH释放杀伤模型, IncuCyte 凋亡检测模型,结果见图3;
➢
基于人PBMC和特异性的肿瘤细胞作用,Tebentafusp介导的T细胞的激活测定,采用的是ELISPOT检测IFNγ的T细胞激活性模型。
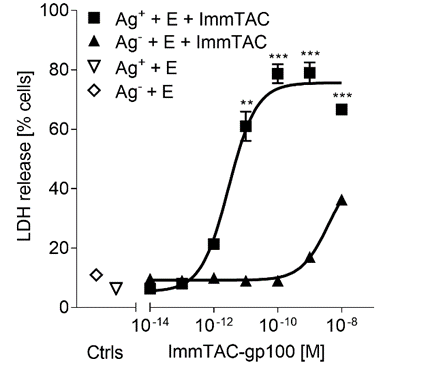
图3 Tebentafusp PBMC杀伤试验结果
通过细胞杀伤试验中Tebentafusp梯度稀释的剂量结果,确定Tebentafusp在1pM-1nM的范围内有有效的杀伤效果,确定最低预期生物有效水平为1pM,用于临床一期起始剂量的设计。
基于免疫调节剂的动物模型的非相关性,美国先后发表了An FDA oncology analysis of CD3 bispecific constructs and first-inhuman dose selection4,An FDA oncology analysis of immune activating products and first-in-human dose selection5两篇文章推荐使用基于人免疫细胞的更加具备相关性的体外试验模型的检测结果进行CD3双抗和免疫激动剂的人体首次用量剂量的外推(具体如图4)。

图4 FDA推荐使用体外的人免疫细胞试验的数据外推首次人体剂量

FLT3抑制剂的血浆药效学评估
如图5所示, 临床阶段FLT3的药效学评估可采用PlA (plasma inhibitory assay)方法进行,该方法是将临床受试者的血浆样品加入过表达FLT-ITD细胞系中培养孵育,基于细胞系中FLT3磷酸化水平的变化用于药效学评估,以预测受试者用药后的效果,FLT3磷酸化水平的变化和患者的预后有较佳的相关性[6]。该方法虽然在临床实践中已得到应用,体外方法是否能够预测体内的反应,其科学性和生理相关性仍然受到质疑,以及PIA的检测方法能否用于其他靶点药物一直未得到解答。
2021年来自约翰霍普金斯大学David J. Young 等发表的文章揭示了PIA方法能够进行患者预后预测的核心因素[7]。小分子药物和血浆蛋白的结合,会导致人体内起到药效的游离状态的药物减少,最终导致临床药效不佳。如下图6所示临床阶段的候选药物化Midostaurin,Lestaurtinib,TTT-3002有类似的结构单元,该类似结构单元能够和血浆中的AGP结合,最终导致药物效果的极大减弱。同靶点临床阶段的候选药物Quizartinib, Sorafenib则跟AGP不结合,在人血浆环境中的药效不会受到显著性影响,最终发挥生理学作用。基于此基础研究,在临床前阶段,采用人血浆作为反应基质,通过药物的体外药效学评估将是一个很好的体外药效学模型用于评估预测人血浆蛋白结合率对药物进入人体后的药效的影响,以及基于PIA方法的数据可作为临床一期的最小起效剂量设计的重要参考。
同时作者的研究也表明由于小鼠的AGP蛋白的种属差异和表达差异,导致小鼠血浆基质对Midostaurin,Lestaurtinib,TTT-3002的影响有限,从血浆蛋白结合的角度来看小鼠动物模型为非相关模型,在研发早期比如PCC阶段采用人来源血浆基质进行候选药物分子的PIA试验有利于筛选得到更加有生理相关性的药效分子,减少临床药物开发的风险。
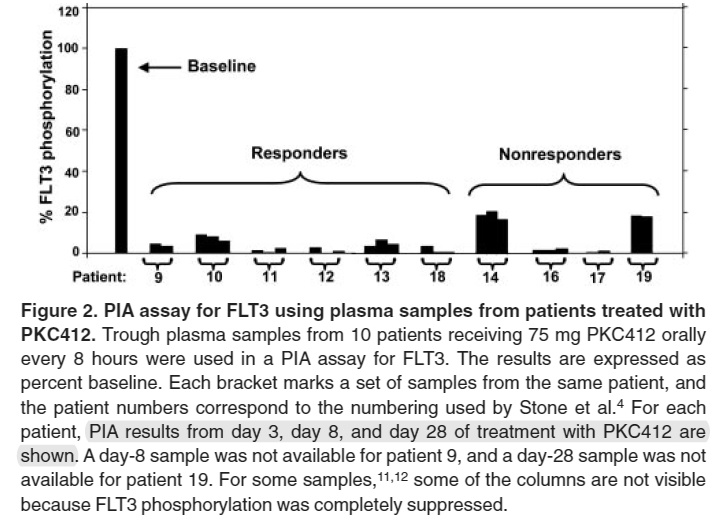
图5 FLT3临床药物PIA方法磷酸化抑制结果和预后的相关性分析
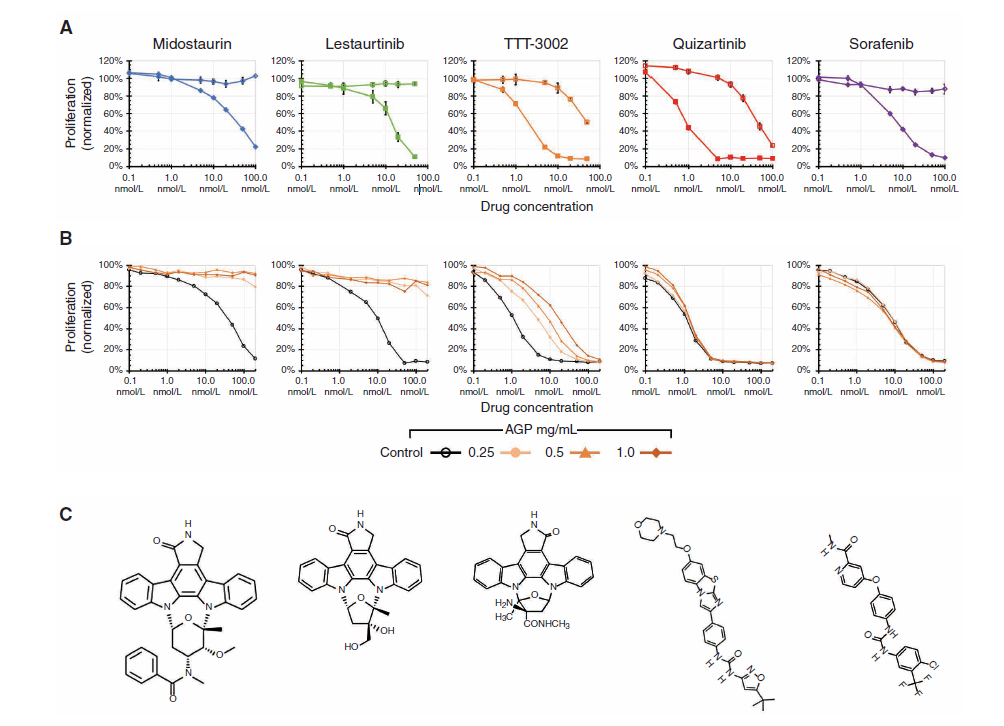
图6 血浆和血浆AGP蛋白对不同结构的FLT3药物活性的影响
PART 03
熙宁|精翰项目经验介绍
熙宁生物|精翰生物有非常丰富的临床阶段药物的药效学评估的经验,如图7所示储备了全血所有基质组分的方法学库,可立足于临床药物效果进行临床前人来源全血基质的药效学评估,并对临床前的数据进行充分的解读,助力申办方的转化医学研究和临床药物一期剂量设计。
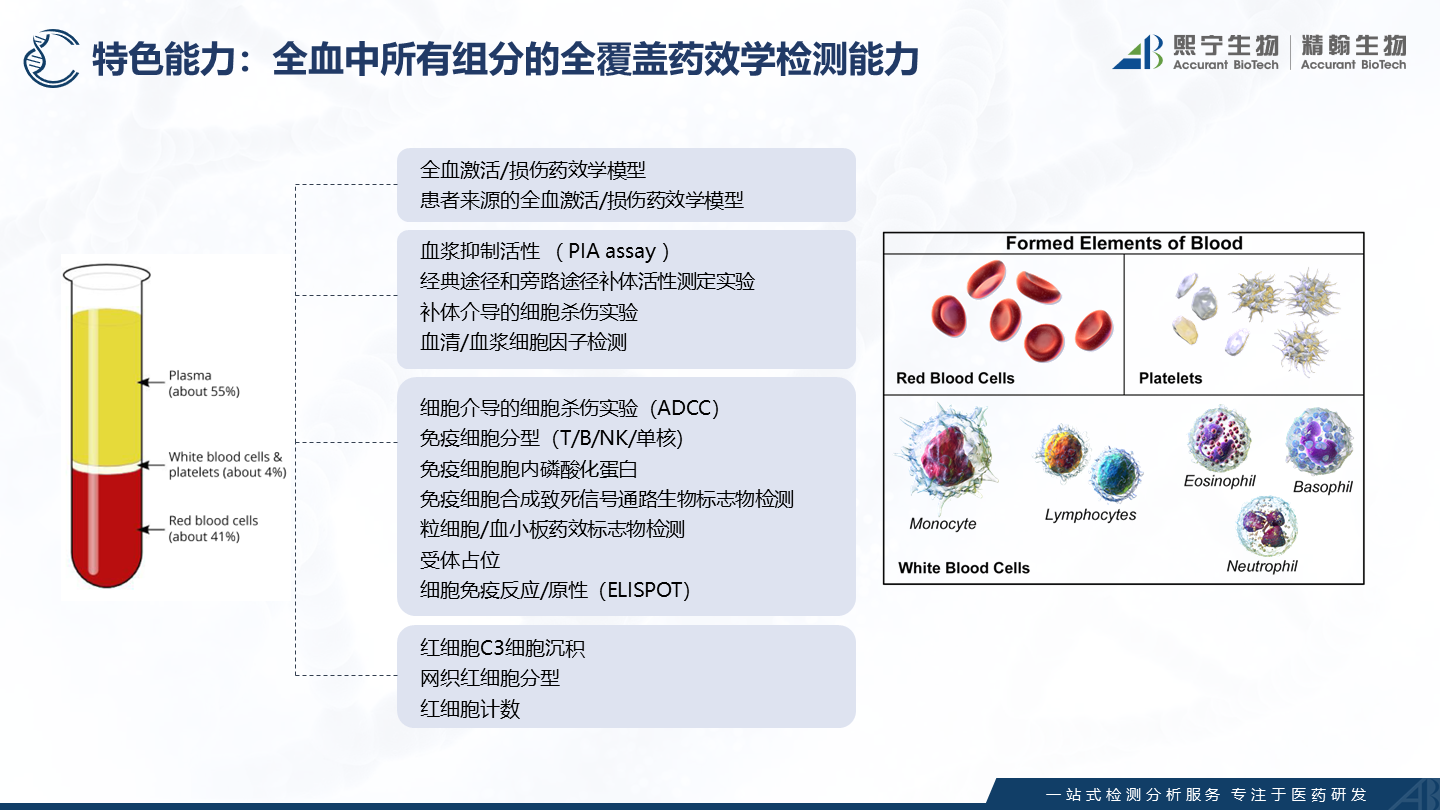
图7 熙宁生物|精翰生物具备全血所有组分的药效学方法学库
同时对于药物作用机理复杂或者全新药物靶点的转化医学研究,熙宁生物|精翰生物可基于丰富的实践经验,深厚的技术积累,前瞻性的研发布局以及经过实战检验的研发体系,进行创新型药效学方法学开发和新型药效生物标志物筛选工作,助力临床前和临床阶段的转化医学研究。
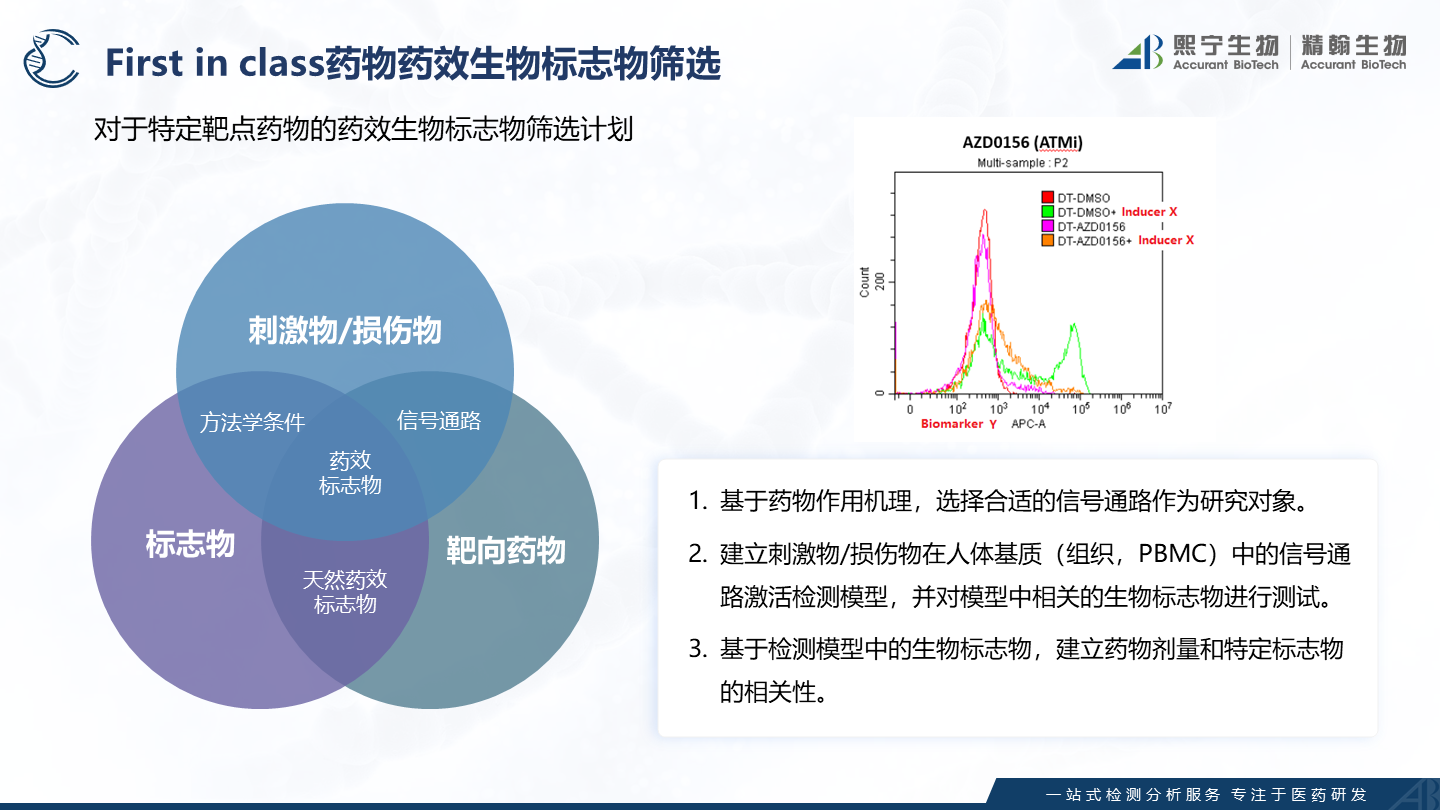
图8 熙宁生物|精翰生物可提供FIC药物的药效生物标志物筛选服务
更多人来源基质的方法学和细节的内容详情见相关公众号文章[8-15]。
参考文献:
[1] ICH S9 抗肿瘤药物非临床评价指导原则
[2] Stebbings R,etc. "Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. J Immunol. 2007 Sep 1;179(5):3325-31.
[3] Harper, Jane , et al. "An approved in vitro approach to preclinical safety and efficacy evaluation of engineered T cell receptor anti-CD3 bispecific (ImmTAC) molecules." PLoS ONE 13.10(2018).
[4] Saber, Haleh , et al. "An FDA oncology analysis of CD3 bispecific constructs and first-in-human dose selection." Regulatory Toxicology & Pharmacology (2017):144-152.
[5] Saber, Haleh , et al. "An FDA oncology analysis of immune activating products and first-in-human dose selection." Regulatory Toxicology & Pharmacology 81(2016):448-456.
[6] Levis, M , et al. "Plasma inhibitory activity (PIA): a pharmacodynamic assay reveals insights into the basis for cytotoxic response to FLT3 inhibitors." Blood 108.10(2015):3477.
[7] Y Young, David J , et al. "A method for overcoming plasma protein inhibition of tyrosine kinase inhibitors. " American Association for Cancer Research (AACR) 5(2021).
[8] 基于人免疫细胞的ADCC功能测定Claudin18.2靶点抗体为例 ---临床阶段的药效学评估分析方法系列1
[9] 基于人全血的T细胞增殖测定CDK抑制剂为例——临床阶段的药效学评估分析方法系列2
[10] 基于人血清的补体功能临床药效学测定:旁路途径检测分析—临床药效学评估检测方法系列3
[11] TYK2抑制剂临床药理学的分析方法解析——临床阶段的药效学评估分析方法系列4
[12] 双特异药物的临床前有效性和安全性评估-上市双特异药物Tebentafusp的案例分享
[13] 流式细胞术检测PD指标—组蛋白H3第27位赖氨酸三甲基化的方法和应用
[14] 免疫调节剂IND申报必检项- 体外细胞因子释放试验方案设计和结果分析
[15] 基于流式细胞术检测临床样品中细胞增殖相关指标-Ki67阳性细胞占比的方法与应用