



随着肿瘤免疫疗法的兴起,免疫系统在肿瘤研究中的作用受到了极大的关注。免疫系统的一些组分或其变化,已被用于肿瘤预后或预测肿瘤免疫治疗的疗效。例如,肿瘤浸润淋巴细胞的存在被证明与一些癌症的良好预后直接相关[1]。然而,尽管一些患者存在高丰度的肿瘤浸润性淋巴细胞,但并不能保证有良好的疗效。因此,需要更深入地了解肿瘤组织中免疫细胞的类型及其激活状态、功能和特异性。作为适应性免疫的关键细胞效应器,T细胞的抗原特异性由T细胞受体(TCR)决定,这意味着TCR库(TCR repertoire)可以反应人类免疫系统的状态[2]。因此,TCR库被认为是一种有前景的生物标志物,对TCR库的研究有助于表征肿瘤细胞与宿主适应性免疫系统的相互作用,指导如何利用现有或新的治疗方法有效地调节免疫反应,以及如何更好地预测肿瘤预后。
PART 01
TCR库作为癌症预后的生物标志物
在一项研究中,Charles等采用半定量多重PCR方法对44例I-IV期黑色素瘤患者的外周血和其中7例患者的转移性淋巴结样本的TCR库多样性进行了研究,并探讨其对临床预后的潜在预测价值[3]。作者使用两个参数对TCR多样性进行量化:反映V-J重排数量的多样性丰富度(diversity richness,DR)和反映种群克隆性的多样性均匀度(diversity evenness,DE)。作者根据DR和DE值分析患者的无进展生存期(PFS)和总生存期(OS),发现患者外周血中较高的TCR库多样性(DR和DE参数)与较长的PFS相关,而多样性对患者OS没有显著影响(PFS和OS均从采样时间开始计算)(图1)。作者还进一步比较了7例患者血液和淋巴结转移瘤中TCR库的多样性(图2)。尽管总体DR和DE值在血液和肿瘤之间无显著差异,但对个体进行分析发现,患者1在血液和肿瘤中均具有最低DR值,肿瘤中具有最低DE值,在采样后疾病进展迅速并在采样四个月后死亡;相反,具有良好预后和较长生存期(接近4年)的患者8在血液和肿瘤中均表现出更高的TCR库多样性。综上,这项研究表明黑色素瘤患者血液和肿瘤中TCR库的多样性具有潜在的预后价值。
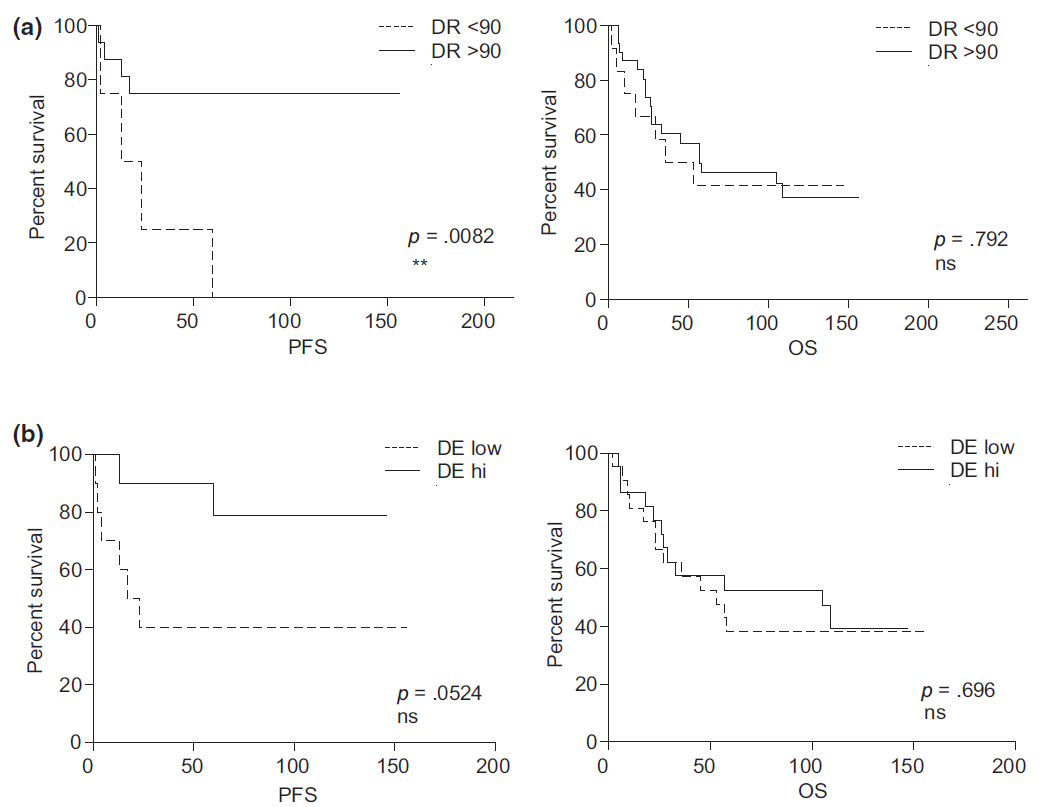
图1 DR和DE参数的数值高预示更长的PFS[3]。通过ImmunTraCkeR®评估黑色素瘤患者血液中TCR库的多样性,并评估其对临床结果的影响: (a) 低DR值 (<90%, n="12)和高DR值">90%, n = 32)患者的PFS (左图)和OS (右图)对比; (b) DE值低于或高于中位数的患者的PFS (左图)和OS (右图)的对比(n = 44)。采用log-rank检验进行分析
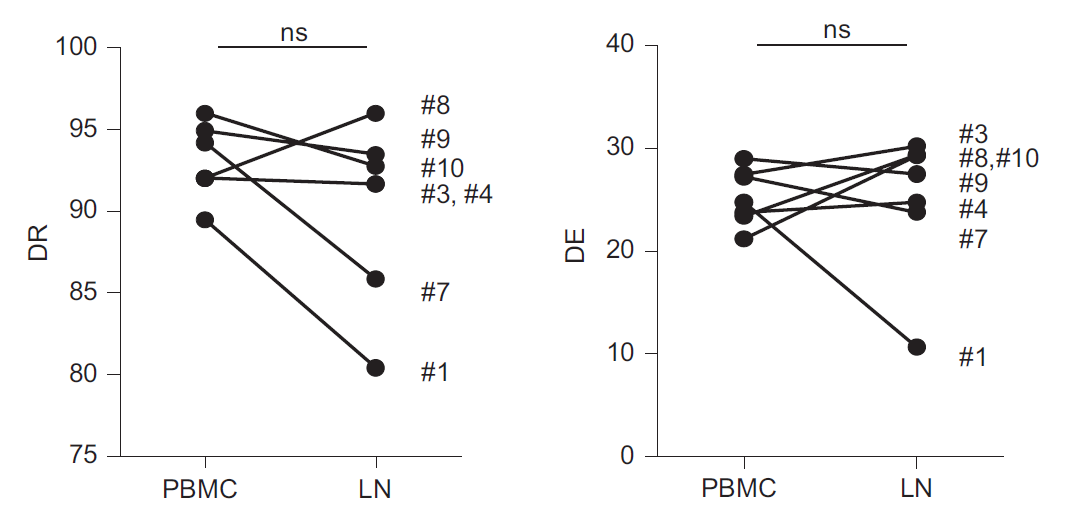
图2 淋巴结(LN)转移瘤的多样性可能为临床结果提供有用信息[3]。通过ImmunTraCkeR®评估黑色素瘤患者血液和淋巴结转移瘤中TCR库的多样性(计算多样性丰富度和均匀度)。血液和淋巴结DR值(左图)和DE值(右图)的对比
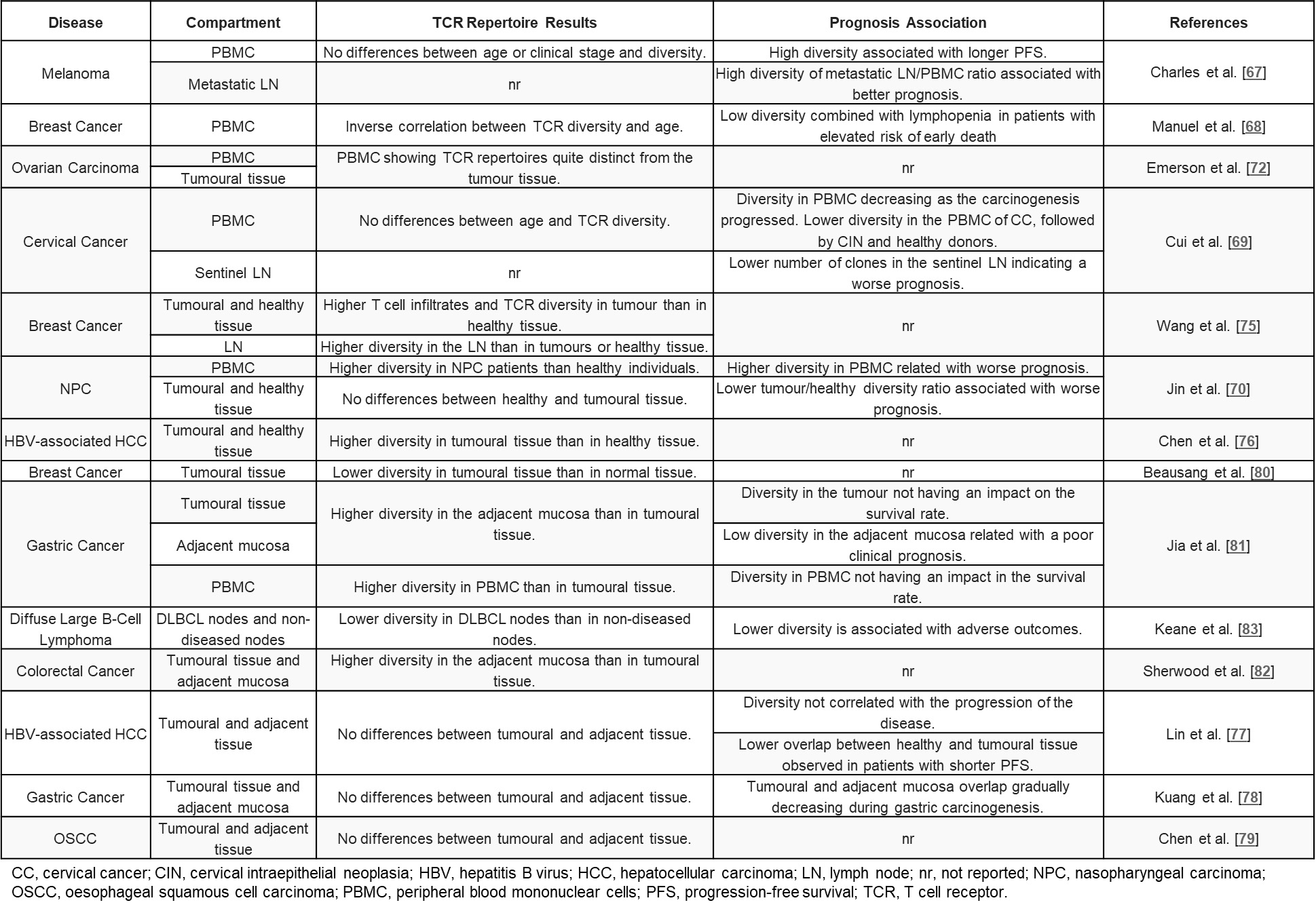
除了黑色素瘤,TCR库对于乳腺癌、宫颈癌、胃癌等恶性肿瘤同样具有一定预后价值(表1)。总的来说,更高的TCR多样性意味着免疫系统具有更好协调抗肿瘤反应的能力,所以在健康个体或疾病进展较好的患者中,TCR库的多样性会更高。
表1 TCR库多样性在肿瘤预后中的作用[1]
PART 02
TCR库作为ICIs治疗的预测生物标志物
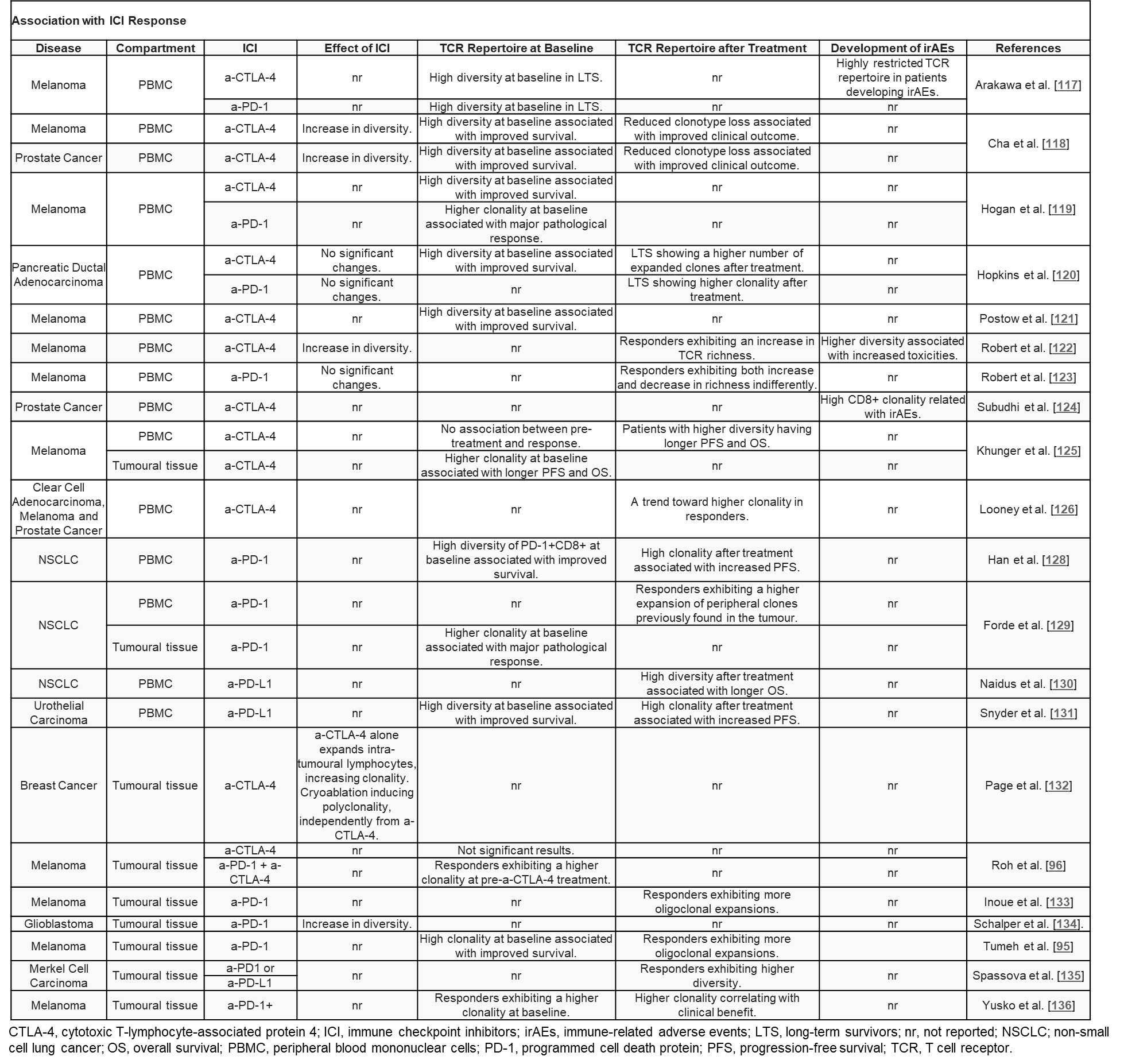
免疫检查点抑制剂(ICIs)的使用已被证明可以提高多种类型肿瘤患者的生存期。到目前为止,用于预测ICIs疗效的生物标志物主要包括PD-L1表达、肿瘤突变负荷(TMB)和肿瘤浸润T细胞。近年来,一些研究试图探索TCR库多样性和克隆性的改变与ICIs治疗期间建立的保护性肿瘤特异性反应之间的关系,主要集中在靶向CTLA-4和PD-1的单克隆抗体这两类ICIs对TCR库多样性的影响(表2)[1, 4]。由于难以获得纵向肿瘤组织样本,这些研究大多使用循环T细胞,少数使用肿瘤浸润T细胞。
表2 不同肿瘤研究中ICIs治疗后的TCR库分析[1]
在一项试点研究中,Postow等人分析了12例转移性黑色素瘤患者在接受ipilimumab(anti-CTLA-4 antibody)治疗前的外周血TCR库多样性,以确定治疗前TCR库多样性是否与ipilimumab治疗的临床结果相关[5]。作者通过丰富度(richness,观察到的V-J重排)和均匀度(evenness,特定V-J重排频率之间的相似性)这两个参数来研究TCR库的多样性。临床获益通过ipilimumab开始治疗后肿瘤负荷减轻或疾病稳定时间延长至少9个月的证据来确定。结果显示(图3),有无临床获益的患者在TCR库丰富度(p = 0.033)和均匀度(p = 0.028)上都存在显著差异,低丰富度(n = 0/5, p = 0.081)和低均匀度(n = 0/7, p = 0.01)患者均没有临床获益。该研究表明,转移性黑色素瘤患者外周血中基线TCR多样性与ipilimumab治疗的临床结果相关。
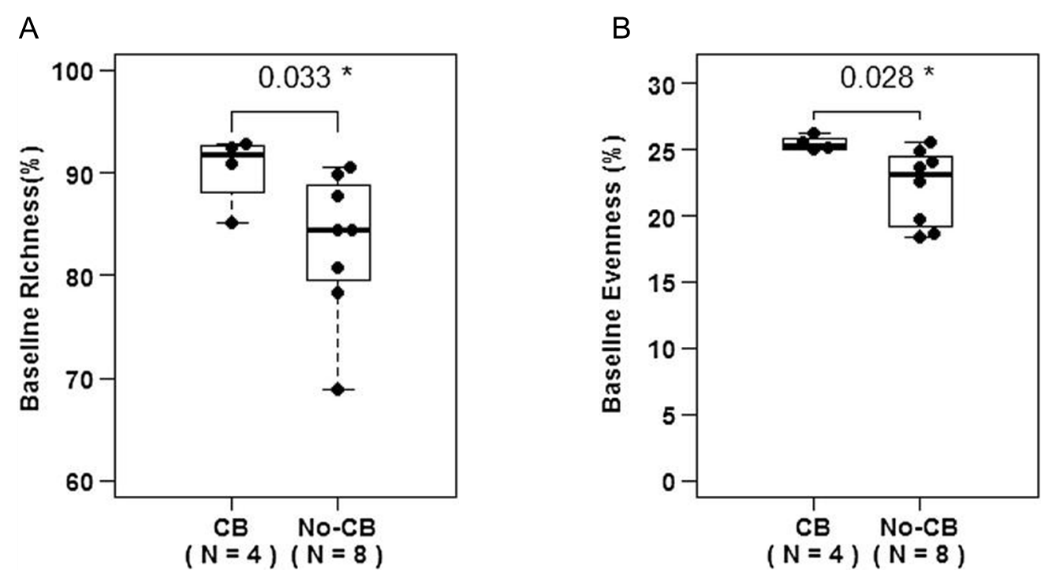
图3 A,有临床获益的患者在基线时TCR库的丰富度更高(p = 0.033);B,有临床获益的患者在基线时TCR库的均匀度更高(p = 0.028)[5]
此外,一些研究发现抗CTLA-4治疗可以增加外周血中TCR库的多样性。例如,为了评价tremelimumab阻断CTLA4对PBMC的免疫调节作用,Robert等人利用NGS评估了21例转移性黑色素瘤患者在接受tremelimumab治疗前、治疗30天和60天后,PBMC细胞中TCR V-beta CDR3的变化[6]。结果显示(图4),接受tremelimumab治疗后,19例患者TCR V-beta CDR3的unique productive sequences中位数增加了30%,另外2例中位数下降30%;治疗后的丰富度(P < 0.01)和Shannon多样性指数(P < 0.04)变化显著。相比之下,从4名健康人的TCR V-beta CDR3多样性在1年内没有显著变化。这项研究说明用tremelimumab阻断CTLA4可以使外周T细胞库多样化,阐明这类抗体如何调节人类的免疫系统。
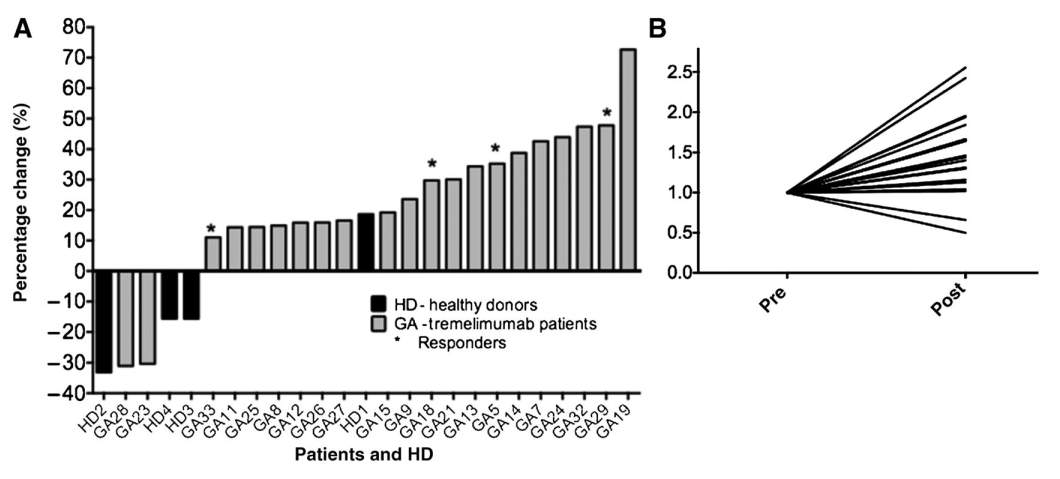
图4 Unique productive sequences绝对数值的变化[6]。A,来自21名黑色素瘤患者(GA,黑色)和4名健康人 (HD,灰色)的基线和tremelimumab治疗后样本之间的变化。B,标准化的TCR V-beta CDR3库多样性。分析比较PBMC样本的基线和tremelimumab治疗后CDR3库的变化,这些数值进行归一化,以可比性的方式显示治疗后的增加和减少
关于抗PD-(L)-1治疗,一些研究也证明了更高的基线外周TCR库多样性与临床获益之间的关联。例如,Han等人对NSCLC患者PD-1+ CD8+ T细胞的TCRβ CDR3进行测序,以研究其在预测NSCLC患者对抗PD-1/ PD-L1治疗反应中的作用(图5)[7]。两个独立的队列(队列A,n = 25;队列B,n = 15)分别作为发现组和验证组。在队列A中, ICB治疗前PD-1+ CD8+ T细胞TCR库多样性高的患者对ICB治疗表现出更优的临床响应和更长的PFS(6.4个月vs 2.5个月,HR,0.39;95%[CI],0.17-0.94;P = 0.021)。类似的结果在队列B中也得到了验证,说明外周血PD-1+ CD8+ T细胞中的TCR库多样性可以作为预测NSCLC对ICB治疗结果的生物标志物。
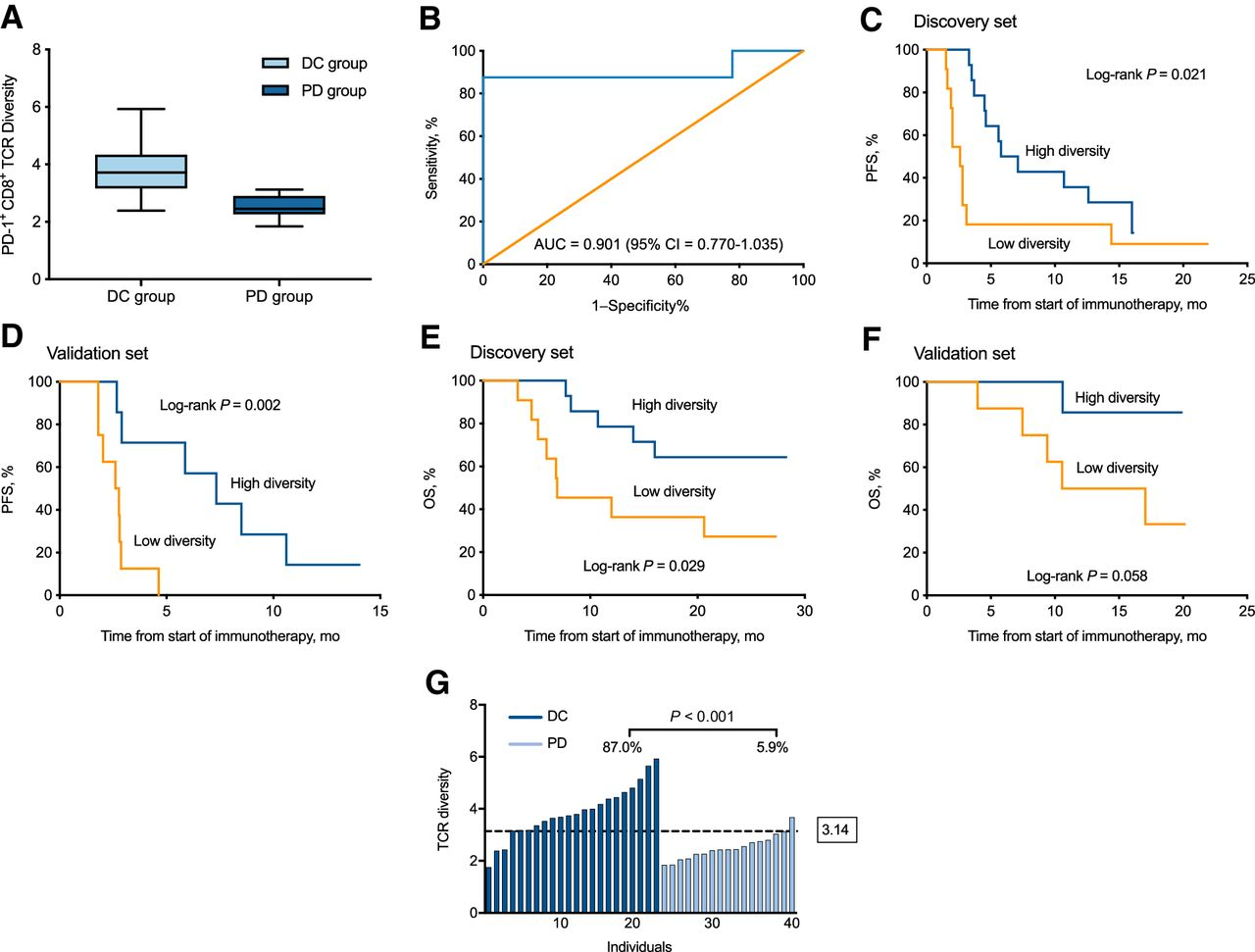
图5 TCR库多样性与PD-1或PD-L1抑制剂治疗的反应和PFS的相关性[7]。A,队列A中PD-1/PD- l1抑制剂治疗后DC和PD亚组PD-1+ CD8+ TCR多样性的比较(n = 25)。B,使用ROC曲线队列A中区分PD患者和DC患者(n = 25)。C,队列A的PFS通过PD-1+ CD8+ TCR库多样性进行分层(n = 25)。D,队列B的PFS通过PD-1+ CD8+ TCR多样性进行分层 (n = 15)。E,队列A的OS通过PD-1+ CD8+ TCR库多样性进行分层 (n = 25)。F,队列B的OS通过PD-1+ CD8+ TCR库多样性进行分层(n = 15)。G, TCR多样性对判断PD-1或PD- L1抑制剂的临床反应(DC vs PD)的敏感性和特异性(n = 40;DC, n = 23, PD, n = 17)
然而,Hogan等人在一项研究发现TCR库多样性与anti-PD-1治疗结果存在负相关(图6)[8]。在该研究中,作者采用multi-N-plex PCR技术测试了接受anti-CTLA4 (n = 42) 或anti-PD1 (n = 38)治疗的黑色素瘤患者在治疗前PBMC的TCR库组合多样性均匀度(DE50,其数值越低,代表TCR克隆越多,多样性越少)。在多变量回归模型中评估治疗结果、临床变量和DE50之间的相关性,并通过Fisher精确检验进行验证。结果显示,低DE50数值预示着患者anti-PD-1治疗有良好反应和更长的PFS,但是对于anti-CTLA-4治疗预示着较差的临床获益。不同研究结果的差异表明,需要更深入的研究,以助于更好地了解其他因素对TCR库变化的影响。
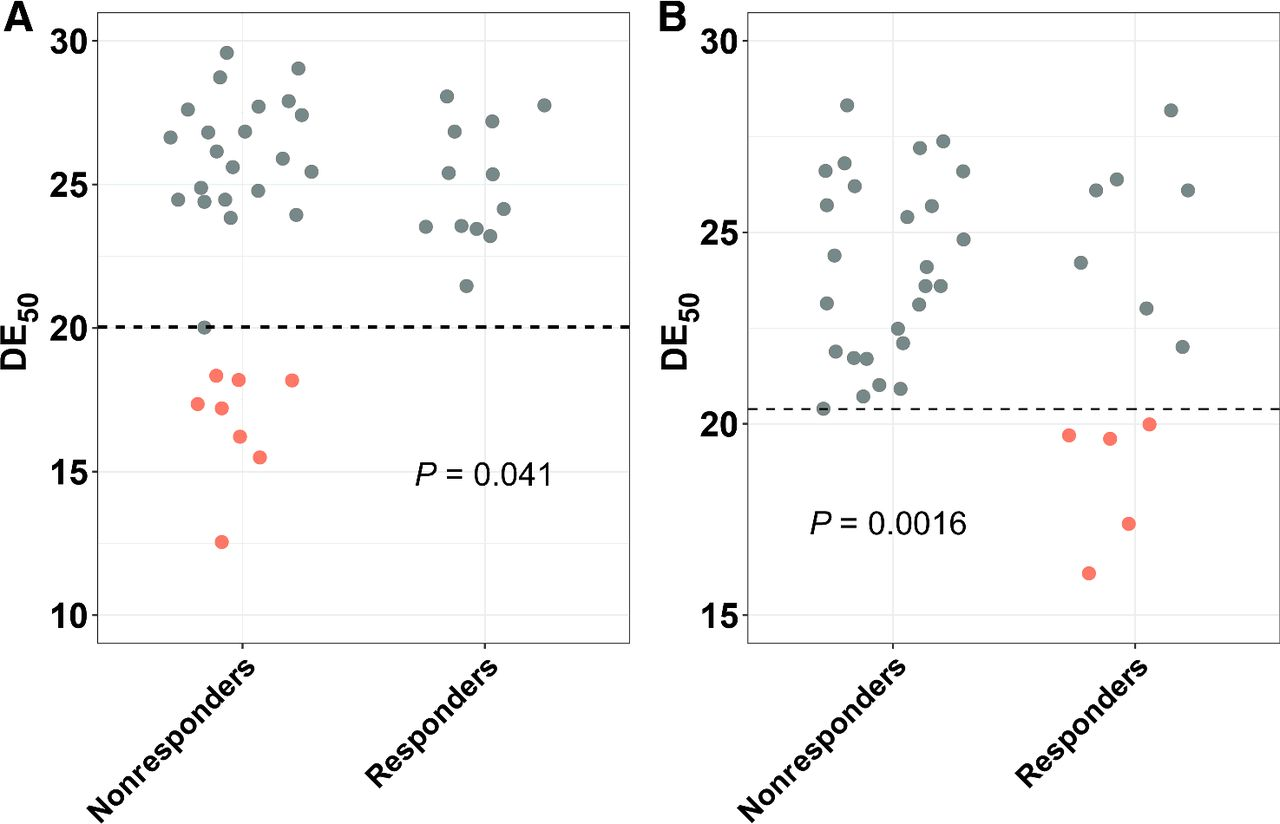
图6 治疗前TCR多样性的均匀度[8]。A,散点图显示对anti-CTLA-4治疗有反应或无反应患者的基线DE50。N = 42。虚线,20.03%。B,散点图显示对anti-PD-1治疗有反应或无反应患者的基线DE50水平。N = 38。虚线,20.4%。用Fisher精确检验计算P值
PART 03
小结
尽管缺乏对TCR库如何影响癌症发展的了解,但目前已有明确的证据表明,TCR库在作为预测肿瘤进展或预测ICIs治疗效果的生物标志物方面具有巨大的潜力。
熙宁|精翰NGS实验室应用基于多重PCR建库的免疫组库检测方法特异性地扩增TCR/Ig受体链编码基因(TRB、TRD、TRG,以及IgH、IgL、IgK),检测T/B细胞受体基因的克隆性重排,在时序样本检测中,通过检测患者体内TCR谱系的变化来评估治疗效果以及跟踪疾病进展或复发。本检测方法已经经过了完善的性能验证,可以供申办方直接使用。
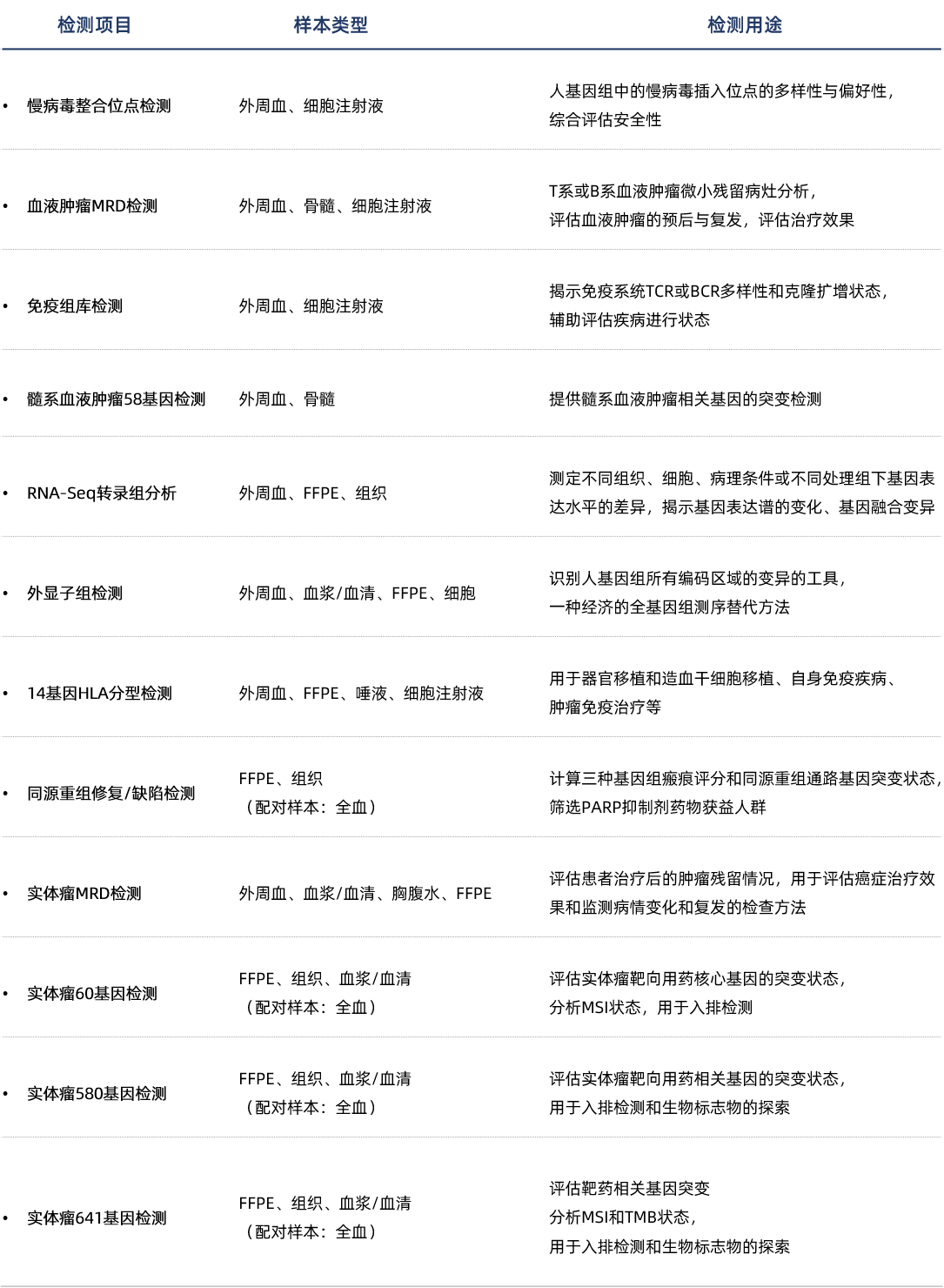
熙宁|精翰NGS实验室依据CAP质量的要求,建立了完善的质量体系。实验室拥有NextSeq CN500测序仪,支持本地测序,且多次满分通过CAP的能力验证。按照质量体系的要求,实验室建立了丰富的检测方法,全面支撑药物的安全性评估、治疗效果评估、入组筛查和生物标志物的探索等,在药物研发的各个环节发挥重要作用:
熙宁 | 精翰NGS平台可提供的检测服务
➢
以慢病毒为载体的CAR-T细胞治疗中,识别有致瘤性的或者其他潜在危险的整合位点,评估整合事件的多样性和偏好性,辅助评估药物潜在的安全性风险;
➢
过对肿瘤微小残留病灶(MRD)的检测,评估药物治疗效果并提示预后,提前提示复发风险并指导后续干预;
➢
通过基因组和转录组测序,帮助申办方识别与疾病关联的基因突变、融合突变和拷贝数变异等,识别受试者药物靶点变异情况,以及与药物转运、代谢和相关信号通路的基因变化,从而指导患者入排,发现药物研发的潜在靶点和生物标志物,并指导耐药机制研究和新的治疗策略开发;
➢
评估候选药物对基因表达的影响,筛选出对特定靶标有显著作用的化合物,同时通过分析药物处理前后基因表达变化,优化药物的剂量、作用机制和潜在副作用。
欢迎后台留言咨询。
参考文献:
[1] Aran A, Garrigós L, Curigliano G, Cortés J, Martí M. Evaluation of the TCR Repertoire as a Predictive and Prognostic Biomarker in Cancer: Diversity or Clonality? Cancers (Basel). 2022 Mar 31;14(7):1771. doi: 10.3390/cancers14071771. PMID: 35406543; PMCID: PMC8996954.
[2] Porciello N, Franzese O, D'Ambrosio L, Palermo B, Nisticò P. T-cell repertoire diversity: friend or foe for protective antitumor response? J Exp Clin Cancer Res. 2022 Dec 22;41(1):356. doi: 10.1186/s13046-022-02566-0. PMID: 36550555; PMCID: PMC9773533.
[3] Postow MA, Manuel M, Wong P, Yuan J, Dong Z, Liu C, Perez S, Tanneau I, Noel M, Courtier A, Pasqual N, Wolchok JD. Peripheral T cell receptor diversity is associated with clinical outcomes following ipilimumab treatment in metastatic melanoma. J Immunother Cancer. 2015 Jun 16;3:23. doi: 10.1186/s40425-015-0070-4. PMID: 26085931; PMCID: PMC4469400.
[4] Joshi K, Milighetti M, Chain BM. Application of T cell receptor (TCR) repertoire analysis for the advancement of cancer immunotherapy. Curr Opin Immunol. 2022 Feb;74:1-8. doi: 10.1016/j.coi.2021.07.006. Epub 2021 Aug 25. PMID: 34454284.
[5] Postow MA, Manuel M, Wong P, Yuan J, Dong Z, Liu C, Perez S, Tanneau I, Noel M, Courtier A, Pasqual N, Wolchok JD. Peripheral T cell receptor diversity is associated with clinical outcomes following ipilimumab treatment in metastatic melanoma. J Immunother Cancer. 2015 Jun 16;3:23. doi: 10.1186/s40425-015-0070-4. PMID: 26085931; PMCID: PMC4469400.
[6] Robert L, Tsoi J, Wang X, Emerson R, Homet B, Chodon T, Mok S, Huang RR, Cochran AJ, Comin-Anduix B, Koya RC, Graeber TG, Robins H, Ribas A. CTLA4 blockade broadens the peripheral T-cell receptor repertoire. Clin Cancer Res. 2014 May 1;20(9):2424-32. doi: 10.1158/1078-0432.CCR-13-2648. Epub 2014 Feb 28. Erratum in: Clin Cancer Res. 2015 Jul 15;21(14):3359. PMID: 24583799; PMCID: PMC4008652.
[7] Han J, Duan J, Bai H, Wang Y, Wan R, Wang X, Chen S, Tian Y, Wang D, Fei K, Yao Z, Wang S, Lu Z, Wang Z, Wang J. TCR Repertoire Diversity of Peripheral PD-1+CD8+ T Cells Predicts Clinical Outcomes after Immunotherapy in Patients with Non-Small Cell Lung Cancer. Cancer Immunol Res. 2020 Jan;8(1):146-154. doi: 10.1158/2326-6066.CIR-19-0398. Epub 2019 Nov 12. PMID: 31719056.
[8] Hogan SA, Courtier A, Cheng PF, Jaberg-Bentele NF, Goldinger SM, Manuel M, Perez S, Plantier N, Mouret JF, Nguyen-Kim TDL, Raaijmakers MIG, Kvistborg P, Pasqual N, Haanen JBAG, Dummer R, Levesque MP. Peripheral Blood TCR Repertoire Profiling May Facilitate Patient Stratification for Immunotherapy against Melanoma. Cancer Immunol Res. 2019 Jan;7(1):77-85. doi: 10.1158/2326-6066.CIR-18-0136. Epub 2018 Nov 13. PMID: 30425105.