



PART 01
ADC药物概述
抗体偶联药物(Antibody-Drug Conjugate,ADC)是一种将小分子毒素(Payload)通过连接子(Linker)连接到靶向肿瘤的单克隆抗体(Antibody)而构成的复合体,兼具传统小分子化疗药物的强大杀伤效应及抗体药物的肿瘤靶向性[1]。ADC药物通过抗体的靶向性将小分子毒素递送到肿瘤细胞内,靶向DNA或微管导致细胞凋亡或死亡。此外,ADC药物也可以通过抗体Fc片段介导的ADCC、ADCP、CDC作用杀伤肿瘤细胞,或者通过抗体特异性结合肿瘤细胞表面抗原,抑制抗原受体的下游信号转导,诱导细胞凋亡[2]。
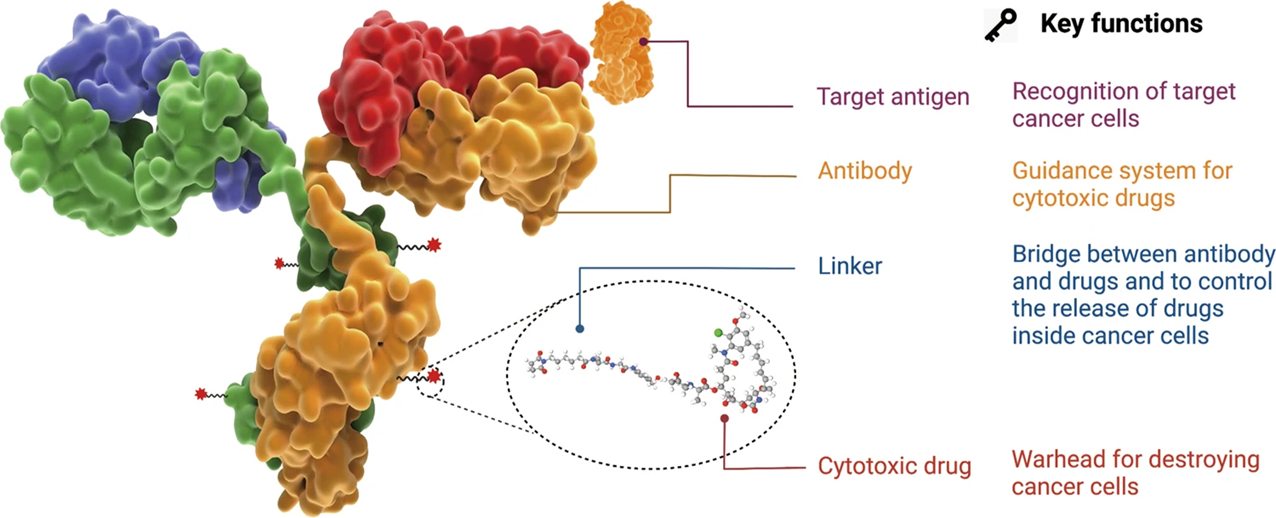
图1 ADC药物的结构与特征[2]
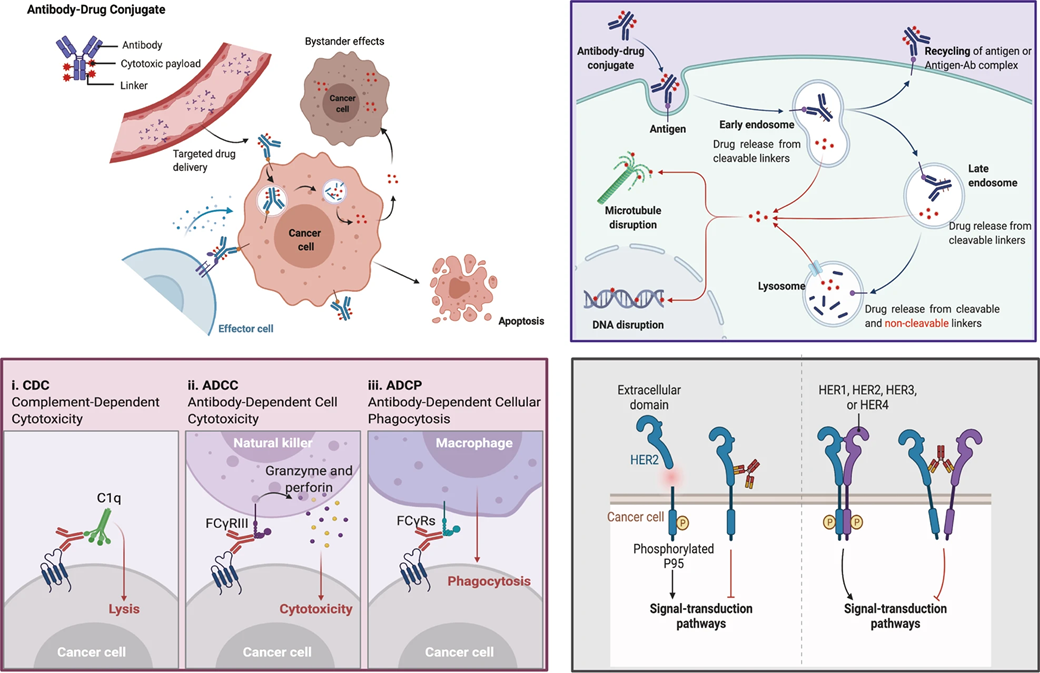
图2 ADC药物杀伤肿瘤细胞的机制[2]
ADC药物的研究可追溯到19世纪初,Paul Ehrlich提出了“魔法子弹(Magic Bullet)”的概念。经过一百多年的发展,ADC药物已经证明了其在肿瘤治疗中的临床应用,成为抗肿瘤领域的一类重要疗法。目前,全球总共上市了15款ADC药物,其中7款在国内获批上市。
表1 上市ADC药物统计

PART 02
生物标志物的定义与分类
生物标志物在抗肿瘤药物临床开发中的价值日益凸显,已逐步成为抗肿瘤药物研发过程中极其重要的一种研发工具,广泛应用于患者的筛查、诊断、临床研究、指导用药、预后等。2021年12月,CDE发布了《生物标志物在抗肿瘤药物临床研发中应用的技术指导原则》,明确了生物标志物的定义——生物标志物通常是指能被客观测量和评价,反映生理或病理过程,以及对暴露或治疗干预措施产生生物学效应的指标。同时,将生物标志物分为六个类型:诊断性生物标志物、预后性生物标志物、预测性生物标志物、药效学生物标志物、安全性生物标志物、监测性生物标志物[3]。

图3 生物标志物的类型与临床应用[3]
PART 03
基于生物标志物的ADC药物临床开发
在ADC药物的抗肿瘤临床开发中,可以通过生物标志物精准筛选潜在的获益人群,提高临床试验的成功率。2023年4月CDE发布的《抗肿瘤抗体偶联药物临床研发技术指导原则》中也提到“鼓励研发人员在早期临床试验阶段就积极开展较为深入的生物标志物探索性研究,根据 ADC的靶点特征探索预测性生物标志物、预后性生物标志物以及药效学生物标志物等”[4]。基于ADC药物的作用机制,临床开发中对于人群选择策略主要依据肿瘤细胞上的靶抗原表达,即以靶抗原为生物标志物进行人群富集、疗效分析。目前已有多个基于靶抗原筛选患者人群的抗肿瘤ADC药物获批上市,例如trastuzumab deruxtecan、mirvetuximab soravtansine。下文将以mirvetuximab soravtansine为例,简单介绍生物标志物是如何助力ADC药物的临床开发,提高ADC药物的临床研发效率。
Mirvetuximab soravtansine(商品名Elahere)是ImmunoGen公司研发的一种靶向叶酸受体α(FRα)的ADC药物,由靶向FRα的嵌合IgG1抗体,可切割的连接子和微管破坏剂DM4组成[5]。2022年11月14日,美国FDA加速批准mirvetuximab soravtansine用于治疗先前接受过1至3种系统性治疗、FRα阳性、铂耐药的上皮性卵巢癌、输卵管癌或原发性腹膜癌的成人患者。
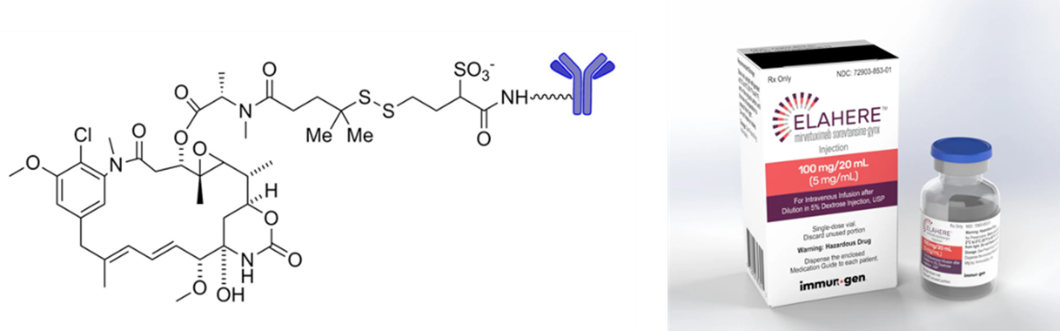
图4 Mirvetuximab soravtansine结构示意图[5]
在一项评估mirvetuximab soravtansine (IMGN853) 安全性和临床活性的I期扩展队列研究中,一方面以FRα阳性(≥25% 肿瘤细胞具有 ≥2+ IHC染色强度)为入组标准富集患者;另一方面,依据FRα表达水平进行亚组分析:低(25~49%肿瘤细胞具有≥2+ IHC染色强度)、中(50~74%肿瘤细胞具有≥2+ IHC染色强度)或高(≥75%肿瘤细胞具有≥2+ IHC染色强度)。结果显示FRα的表达水平与抗肿瘤活性相关,高表达FRα的患者具有更高的ORR和更长的mPFS,表明FRα可以作为预测性生物标志物,用于精准筛选对IMGN853治疗获益的患者[6-7]。
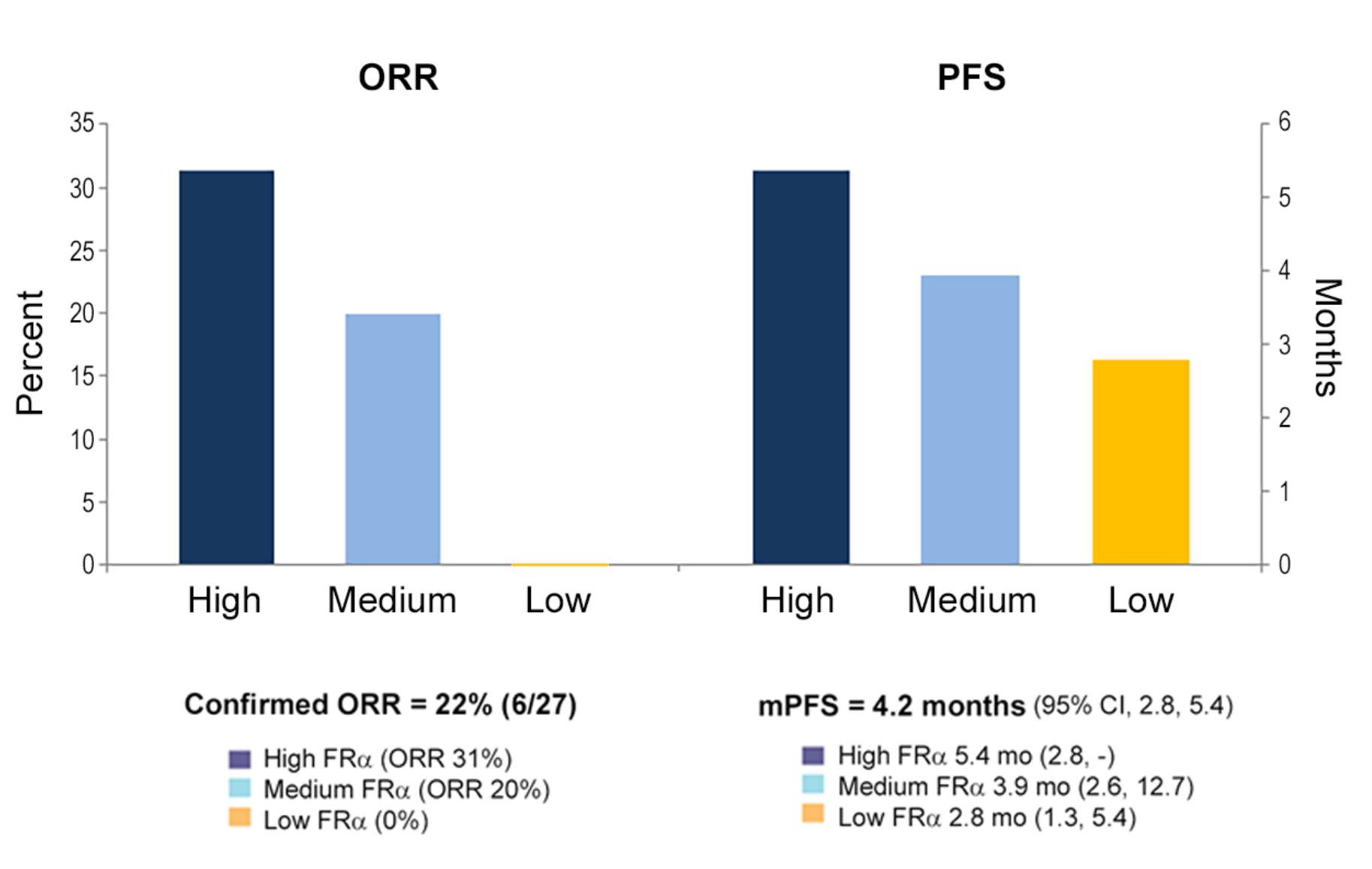
图5 基于FRα表达水平分析IMGN853的临床疗效[7]
基于I期的实验结果,ImmunoGen启动了一项随机、开放标签的III期试验FORWARD I(NCT02631876),以比较在既往接受过三种或更少治疗且FRα中/高表达(≥50%的肿瘤细胞在≤×10显微镜下可见任何FRα膜染色)的铂耐药患者中,MRIV(IMGN853)与研究者选择化疗方案的安全性和有效性。
FORWARD I试验结果显示[8],对于ITT人群,在主要终点无进展生存期(PFS)上,MRIV治疗组与化疗组无显著性差异(HR, 0.98; 95% CI, 0.73~1.31; P=0.897),中位PFS分别是4.1个月和4.4个月;在所有次要终点上, MIRV治疗组相比化疗组表现出更优的临床疗效:confirmed ORR(22% vs 12%; P=0.049),CA-125 response(51% vs 27%; P<0.001)。对于FRα高表达人群,MIRV治疗组的PFS比化疗组的更长(mPFS, 4.8 months vs 4.1 months; HR, 0.69; 95% CI, 0.48~1.00; P=0.049),但由于预设的显著性差异P<0.025,所以FRα高表达亚组的PFS也未达到主要研究终点。在次要终点上,FRα高表达人群的 MIRV治疗组同样比化疗组表现出更优的临床疗效:confirmed ORR(24% vs 10%; P=0.014),CA-125 response(53% vs 25%; P<0.001)。
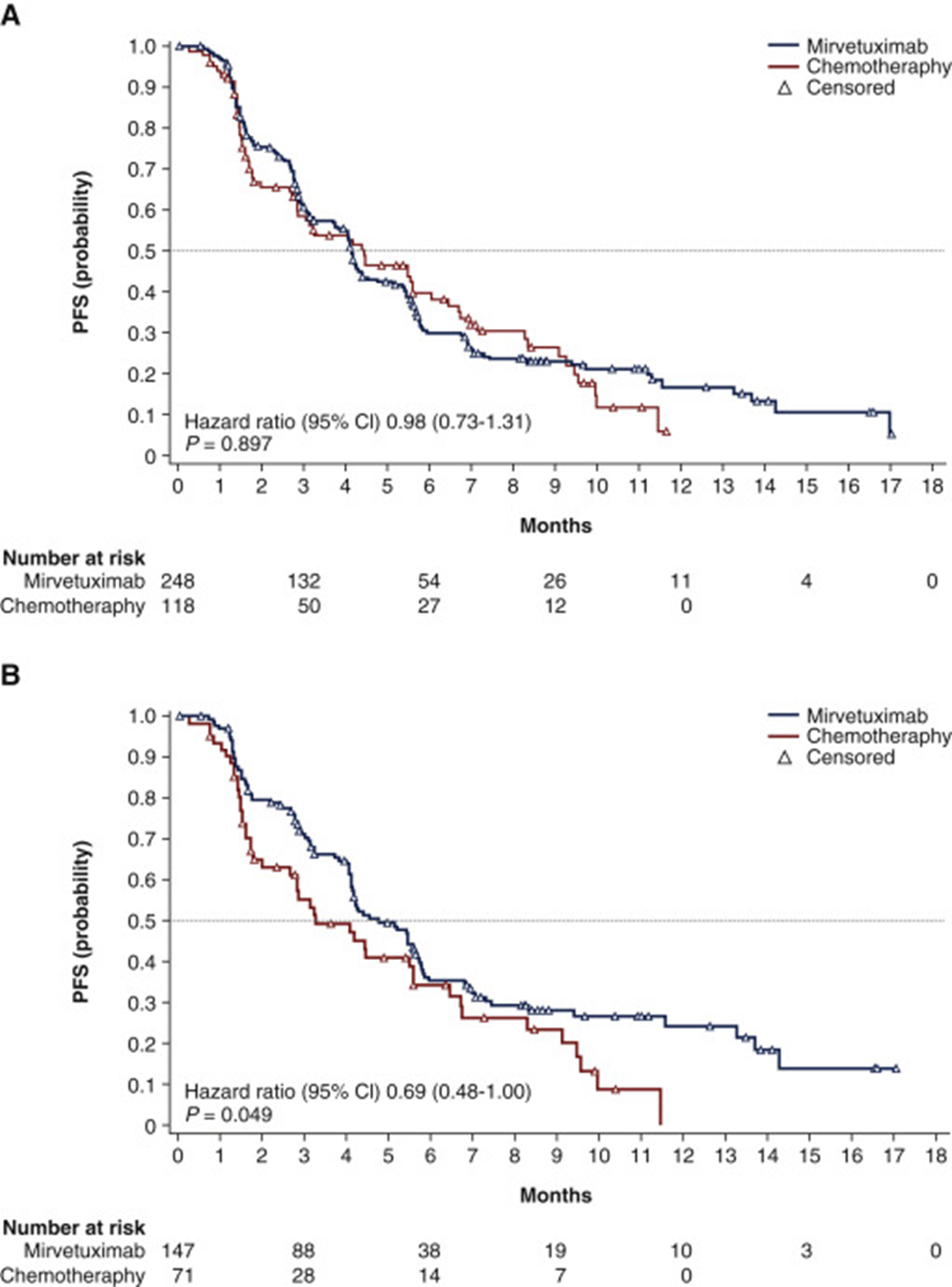
图6 Kaplan-Meier分析FORWARD I试验中mirvetuximab soravtansine和化疗组在(A)意向治疗人群和(B)预先确定的FRα高表达患者亚群中的无进展生存期(PFS)[8]
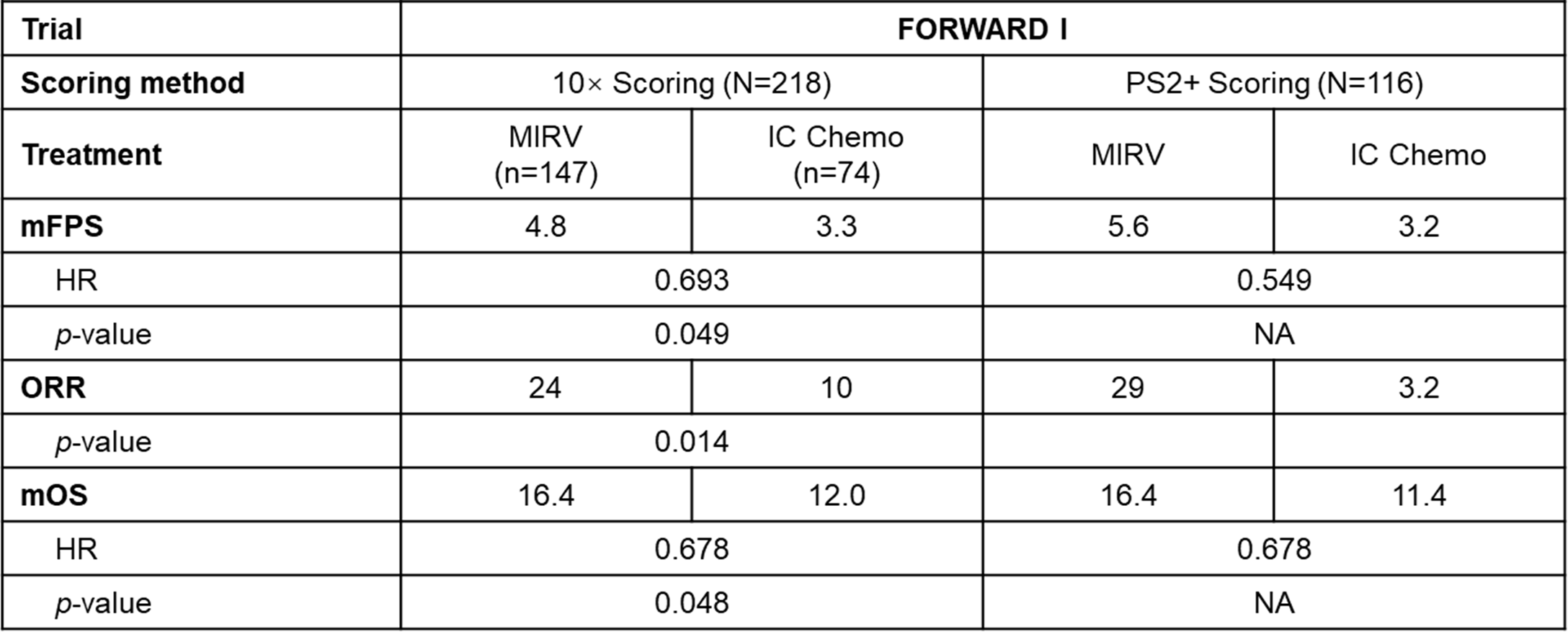
探索性分析表明,FORWARD I试验使用了简化的评分方法(10× scoring)来评估肿瘤样本中的FRα表达,无意中将FRα水平低于预期的患者纳入。当使用I期临床研究中的评分方法(PS2+ scoring)重新评估FORWARD I肿瘤样本时,发现有相当大比例的患者是FRα低表达的。利用PS2+方法评分的FORWARD I患者的探索性疗效分析显示,疗效与FRα表达相关,在所有疗效终点中,FRα高表达人群(n=116)具有最强的治疗效果[9]。
表2 FORWARD I试验中不同评分方法
确定的FRα高表达人群的疗效对比 [8-9]
基于FORWARD I的经验教训,ImmunoGen启动了MIRV在铂耐药、FRα高表达(PS2+评分:≥75%肿瘤细胞具有≥2+ IHC染色强度)EOC患者中的后续两项III期临床试验: 关键性试验SORAYA(NCT04296890)和验证性试验MIRASOL(NCT04209855)。
SORAYA试验是一项单臂、多中心试验,在104例接受mirvetuximab soravtansine治疗的患者中,总缓解率(ORR)为31.7% (95% CI: 22.9, 41.6),中位缓解持续时间(DOR)为6.9个月(95% CI: 5.6, 9.7)[10]。基于该试验的结果,FDA加速批准mirvetuximab soravtansine上市。同时,VENTANA FOLR1 (FOLR-2.1) RxDx Assay也被批准作为选择患有该适应症患者的伴随诊断试剂。
表3 SORAYA试验疗效评估(数据来源:Drugs@FDA)

MIRASOL是一项随机、开放标签的III期试验,以铂耐药、FRα高表达(≥75%肿瘤细胞具有≥2+ IHC染色强度)的PROC患者中,MRIV与研究者选择化疗方案的安全性和有效性。与IC化疗相比,MIRV在无进展生存期、总缓解率和总生存期上都表现出更优的疗效:mPFS(5.62 months vs 3.98 months; HR, 0.65; 95% CI, 0.52~0.81; P<0.0001),ORR(42% vs 16%,P <0.0001),mOS(16.46 months vs 12.75 months; HR, 0.67; 95% CI, 0.50~0.89; P = 0.0046)[11]。
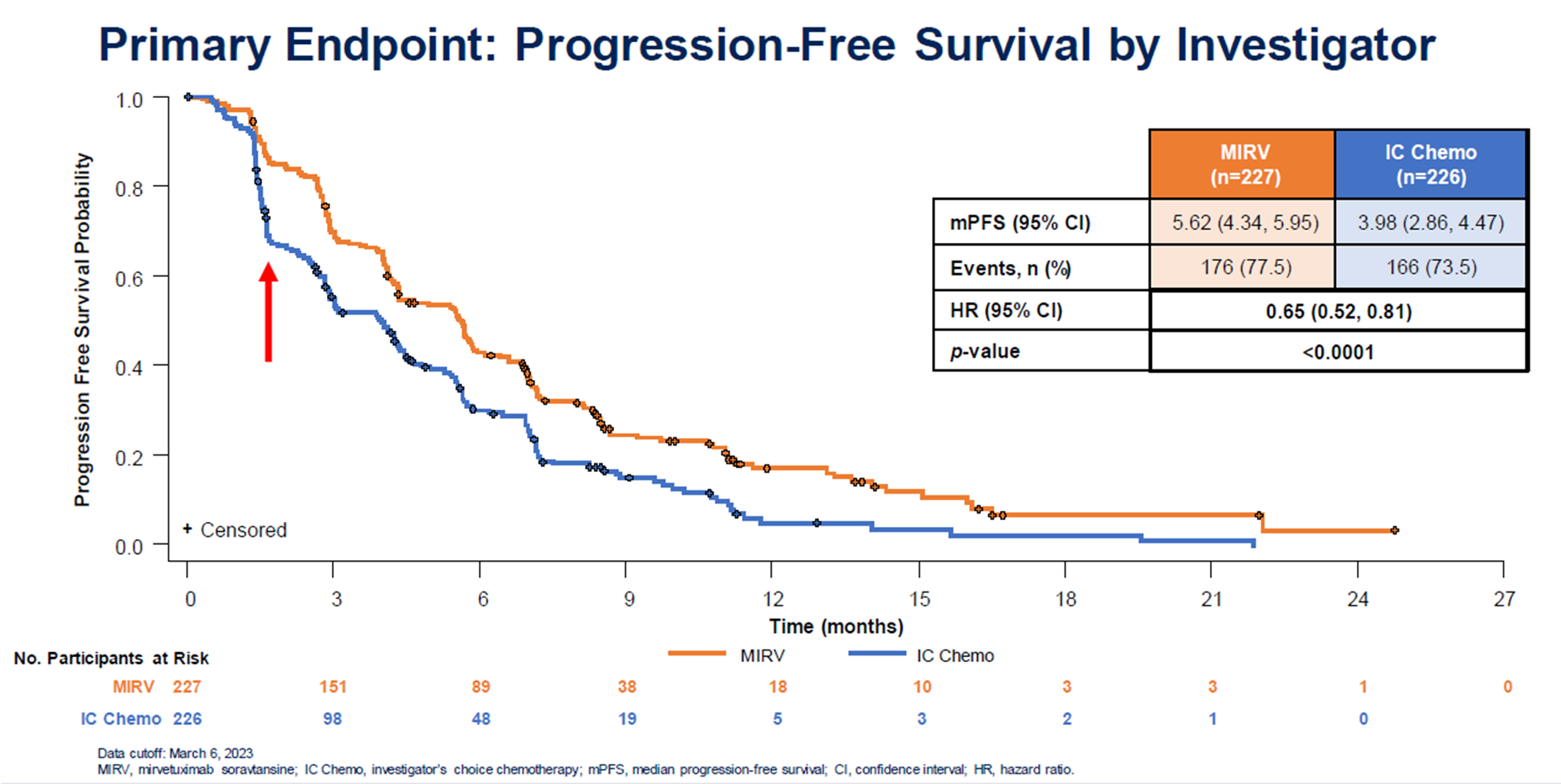
图7 Kaplan-Meier分析MIRASOL试验中MIRV和
化疗组在FRα高表达患者中的无进展生存期[11]
Mirvetuximab soravtansine的成功上市充分证明了生物标志物的合理应用可以提高临床研发效率。从mirvetuximab soravtansine的早期临床试验阶段就开展生物标志物的探索性研究,到后期的关键性临床试验中不断验证并确证其价值,同时也在评估生物标志物cut-off值的合理性以及开发伴随诊断试剂,充分发挥了生物标志物在获益人群选择的作用。
PART 04
熙宁生物|精翰生物FRα检测方法简介

质控选择
在人体正常组织或肿瘤组织中,使用IHC方法检测FRα,可看到染色主要定位于细胞膜,部分伴有较弱的细胞质染色。使用正常肝组织作为阴性质控、浆液性卵巢癌组织作为阳性质控。
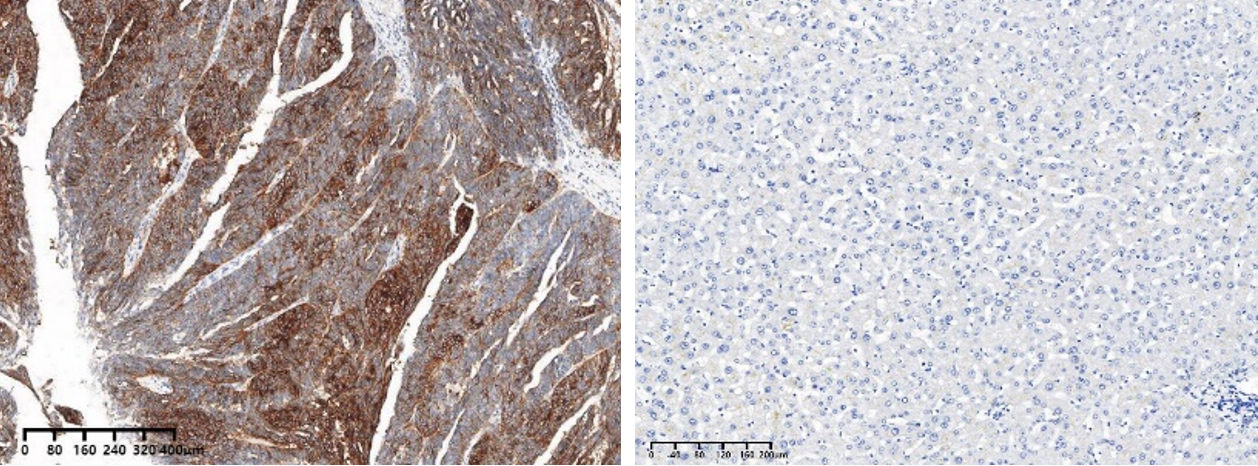
FRα卵巢癌染色 FRα正常肝染色
图8 FRα阳性/阴性质控染色(熙宁生物IHC实验室)

评分方法
参考MIRV III期临床试验SORAYA中FRα表达水平的检测评分方法,我们建立了FRα的H-score评分标准(如下表所示)。
表4 FRα的H-score评分标准

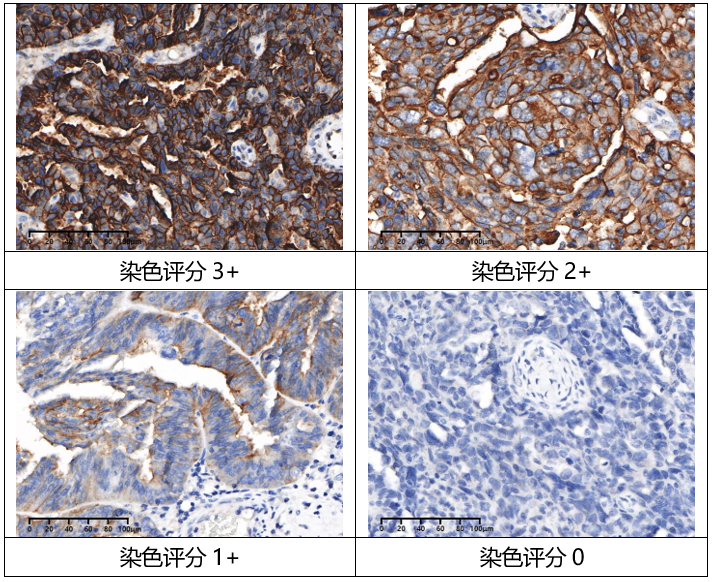
图9 FRα染色等级示意图(熙宁生物IHC实验室)
PART 05
熙宁生物|精翰生物的生物标志物检测
和伴随诊断产品开发经验
熙宁生物|精翰生物的生物标志物检测和伴随诊断产品开发平台具备完善的质量体系,遵循CAP和GCP体系要求,服务药企临床检测与伴随诊断产品开发需求。我们的生物标志物平台目前已具备全面覆盖不同样本的检测能力,积累了大量的生物标志物检测经验,可以从组织、细胞、蛋白、基因和分子各个维度提供相应的检测方案,对于常见的生物标志物已经开发出相应的自主产权方法学,部分展示如下:
上下滑动查看
熙宁生物|精翰生物现已开发完成200余种IHC方法,涵盖ADC药物的热门靶点HER2、HER3、EGFR、FRα、Trop2、Nectin-4、c-Met、Claudin18.2、B7-H3、MSLN等,多个方法获得权威室间质评认可。
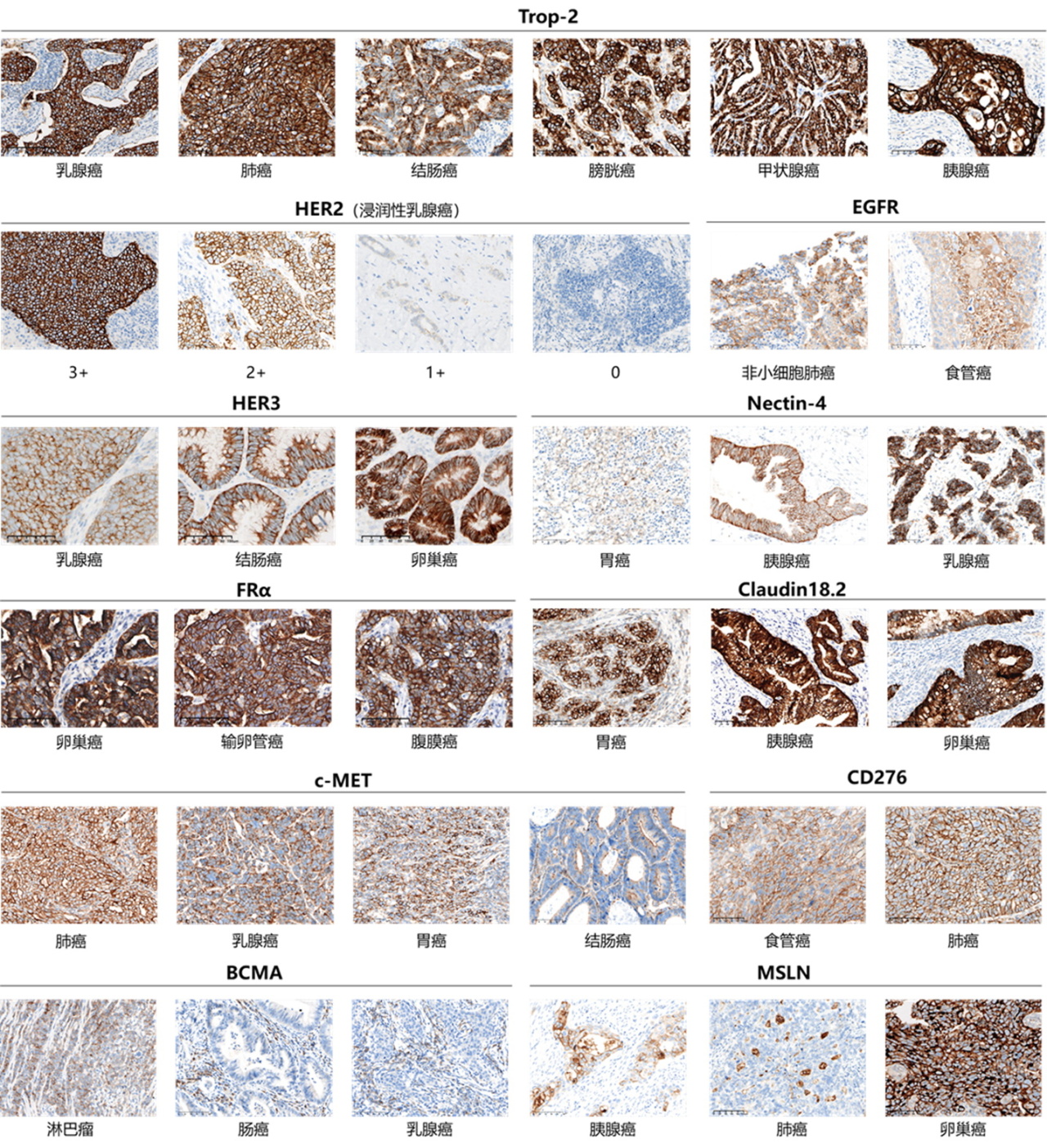
图10 熙宁生物IHC方法开发经验
对于客户的伴随诊断试剂开发需求,熙宁生物|精翰生物已筛选出多株具有CDx开发价值的单克隆抗体,并完成了前期的试剂盒开发。熙宁生物|精翰生物可随时为广大药企客户提供抗体筛选,方法学开发,样品检测,伴随诊断试剂开发等服务,欢迎后台留言咨询。
表5 熙宁生物|精翰生物已开发的伴随诊断试剂(部分)
图11 熙宁生物|精翰生物开发的伴随诊断试剂实物图(部分)
参考文献
[1] Birrer MJ, et al.. J Natl Cancer Inst. 2019 Jun 1;111(6):538-549.
[2] Fu Z, Li S, et al. Signal Transduct Target Ther. 2022 Mar 22;7(1):93.
[3] 生物标志物在抗肿瘤药物临床研发中应用的技术指导原则,国家药监局药审中心,2021年12月07日。
[4] 抗肿瘤抗体偶联药物临床研发技术指导原则,国家药监局药审中心,2023年04月07日。
[5] Ponte JF, et al. Neoplasia. 2016 Dec;18(12):775-784.
[6] Martin LP, et al. Gynecol Oncol. 2017 Nov;147(2):402-407.
[7] SGO Annual Meeting March 12-15, 2017, Abstract 61.
[8] Moore KN, et al. Ann Oncol. 2021 Jun;32(6):757-765.
[9] https://investor.immunogen.com/news-releases/news-release-details/immunogen-presents-full-data-phase-3-forward-i-study
[10] Matulonis UA, et al. J Clin Oncol. 2023 May 1;41(13):2436-2445.
[11] 2023 ASCO Annual Meeting.