



基因治疗和细胞治疗
1990年美国医学家W.F. Anderson对患有腺苷脱氨酶缺乏症的4岁女孩进行基因治疗,成为世界上首个基因治疗成功的范例和重要里程碑。经过几十年的发展,基因治疗为患者“从根本上进行疾病治疗”带来了新的希望。
按照治疗方式,基因治疗可分为2类,体内治疗是直接向血液或者目标器官中注射携带所需基因的载体,如单基因遗传病、血友病及眼科疾病领域的应用。体外治疗,又可称为细胞治疗,是把患者的细胞从体内移出,通过在体外对于细胞进行基因改造,重新输入至患者的体内。其中嵌合抗原受体T细胞疗法(CAR-T)是一种治疗肿瘤的新型精准靶向疗法。
截至目前,已有20余款基因治疗药物和 8款CAR-T产品获得各国药品监管机构的批准。基因和细胞治疗药物凭借先进的生物技术和广阔的治疗前景,将在未来人类疾病的防治中发挥重要作用。
慢病毒整合
对于基因和细胞治疗而言,基因递送的方式和效率直接决定了药物的治疗效果,因此载体的选择显得尤为重要。由于感染谱广泛,可以有效感染分裂期和静止期细胞,长期稳定表达外源基因,慢病毒系统被广泛地应用于基因和细胞治疗等实验中。
病毒整合是慢病毒正常生活周期(Lifecycle)的重要环节(图1)。病毒识别宿主细胞表面受体,将RNA及蛋白转移至胞内。随后RNA逆转录为DNA,整合酶识别病毒DNA携带的LTR,以随机或半随机方式切断宿主基因组,产生的粘性末端会与病毒DNA连接,从而完成外源基因的插入。病毒整合是外源基因表达、实现基因治疗效果的必要条件。

图1 慢病毒生活周期(Lifecycle)
病毒载体整合至宿主细胞基因组,可能破坏基因组的内源性基因表达1。随着研究的进一步深入,科学家发现慢病毒等逆转录病毒的整合不是完全随机的,其中慢病毒整合更容易发生在活跃转录的基因中,存在致病的潜在风险2。2005年巴黎进行的治疗X连锁重症联合免疫缺陷(SCID)的临床试验,发现在接受基因治疗的患者中出现明显的白血病或恶性克隆扩增的症状3。
对于CAR-T细胞治疗,研究显示部分病毒插入突变与治疗后复发相关。Shah et al2等报道一名急性淋巴细胞白血病(ALL)患者,接受抗CD22 CAR-T细胞疗法后复发,可能是由于CAR意外插入CBL基因、53天后出现的二次克隆扩增。Ruella et al4等报道一名ALL患者接受CAR-CD19治疗的复发,发现一个携带CAR插入位点的CAR-B细胞克隆,研究人员最终确定,癌变B细胞里的CAR是制作CTL019细胞时意外引入的。癌变的B细胞获得了CAR,便遮挡了CD19,CAR-T因此无法识别癌细胞。
整合位点分析的法规要求
基于整合载体的潜在致病性,国内外法规均有相关安全性分析的条款。美国FDA 最新发布《嵌合抗原受体(CAR)T 细胞治疗的研发考量》,指出“对包括整合载体的产品推荐进行长期随访,因为整合载体可能会增加延迟不良事件的风险”。EMA和IHC等机构同样推荐在治疗过程中或者长期随访中,分析整合位点。
国家药监局5月最新推出《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》明确指出,“基因插入位点和拷贝数:由于其关系到产品的安全性和有效性,需采用适用的检测方法进行研究,探索其与安全性和疗效的相关性”。同期发布的《体内基因治疗产品药学研究与评价技术指导原则(试行)》指出,“分析载体在基因组中的整合方式和整合位点的分布趋势,评估其插入导致细胞发生基因突变、基因失活/激活,或细胞癌变的风险”。
病毒整合位点分析方法
病毒整合最初采用Southern blot和基因组文库来分析整合位点特征5。 PCR技术因操作简单,结果准确,逐渐取代Southern blot成为病毒整合的主要分析方法。根据PCR技术路线差异,病毒整合主要分为反向PCR(Reverse PCR)、接头PCR(Ligated Mediated PCR, LM-PCR)和线性扩增PCR(Linear Amplification Mediated PCR, LAM-PCR)等。
反向PCR,将DNA酶切打断后连接成环,设计反向引物扩增,可得到病毒整合位点两侧的未知序列。由于连接酶成环效率较低,反向PCR使用受限。LM-PCR,在DNA酶切打断后,两端连接含接头,根据病毒DNA和接头固定序列设计引物扩增,即解锁病毒整合位点的位置信息(图2)。LM-PCR原理简单,易于操作,从发明之日起应用至今。LAM-PCR,首先线性扩增DNA,扩增得到的单链产物通过LM-PCR将单链扩增的特异性产物继续放大。由于引入线性扩增,LAM-PCR的灵敏度和特异性极大提高,超过反向PCR和LM-PCR,应用广泛(图2)。

图2 反向PCR、LM-PCR和LAM-PCR技术路线示意图
传统PCR技术分析整合位点依赖限制性内切酶酶切,存在一定偏好性;同时电泳或者一代测序灵敏度较低,分析克隆数量有限。随着2005年第一台高通量测序仪罗氏454问世,二代测序(NGS)逐步取代PCR,成为整合位点分析的主流技术。由于测序数据量大,二代测序极大地扩展了整合位点数量,特别是低频整合克隆的检出,为药物开发提供更多可参考信息。
高通量测序文库构建流程与PCR相比更为复杂。常用文库构建方法包括LM-PCR、LAM-PCR和非限制性酶切LAM-PCR(nrLAM-PCR)等(nrLAM-PCR以LAM-PCR为基础,剔除了内切酶酶切操作)。LAM-PCR和nrLAM-PCR方式建库,在线性扩增中引入生物素标记引物和链霉亲和素标记磁珠,流程复杂,成本较高6。LM-PCR通过2步PCR富集插入位点序列,6~7h即可完成建库,操作简单,大大加快建库周期,是慢病毒插入位点检测的理想选择。
熙宁生物最新推出慢病毒整合位点NGS检测技术bLM-PCR。bLM-PCR以LM-PCR技术为基础,与其他建库方法相比,操作简单、实验周期短且成本低廉。此外,慢病毒两端各有一个LTR序列,两个LTR均通过LM-PCR发生扩增,因此常规建库方法有一半reads是LTR与Provirus(前病毒插入序列)的无用整合信息。熙宁bLM-PCR通过引入靶向Provirus的特异性探针(图3 blocker),阻断5’LTR无效整合位点reads的扩增,可节省一半的测序数据量和一半的测序成本。
欢迎垂询!
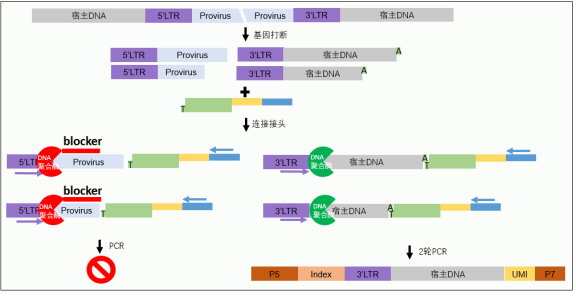
图3 bLM-PCR建库技术路线
参考文献
1.Desfarges, S. & Ciuffi, A. Retroviral integration site selection. Viruses 2, 111–130 (2010).
2.Shah, N. N. et al. Clonal expansion of CAR T cells harboring lentivector integration in the CBL gene following anti-CD22 CAR T-cell therapy. Blood Adv. 3, 2317–2322 (2019).
3.孟坡. 慢病毒介导的转基因整合位点研究方法. 医学分子生物学杂志 5, 42–64 (2008).
4.Med, N. et al. Induction of resistance to chimeric antigen receptor T cell therapy by transduction of a single leukemic B cell. Nat. Med. 24, 1499–1503 (2019).
5.Nusse, R. et al. Retroviral insertional mutagenesis in murine mammary cancer. Proc. R. Soc. London. Ser. B, Biol. Sci. 226, 3–13 (1985).
6.Hamada, M. et al. Integration Mapping of piggyBac-Mediated CD19 Chimeric Antigen Receptor T Cells Analyzed by Novel Tagmentation-Assisted PCR. EBioMedicine vol. 34 18–26 (2018).
熙宁生物按照《医疗机构临床基因扩增检验实验室管理办法》、《分子病理诊断实验室建设指南(试行)》和《医疗机构临床基因扩增检验实验室工作导则》要求建立NGS实验室。实验室配备illumina CN500测序仪(注册备案)、Covaris M220基因打断仪和安捷伦自动化电泳仪4150等仪器,可完成常规文库构建和上机测序实验。技术团队核心人员有5-10年NGS方法开发经验,曾在头部基因检测公司牵头完成肿瘤大panel检测、全外显子测序和RNAseq等项目。