



前言
抗体药物偶联物(antibody-drug conjugate,ADC)是一类重要的靶向治疗药物。ADCs是通过一个化学链接将具有生物活性的小分子药物连接到单抗上,单抗作为载体将小分子药物靶向运输到目标细胞中。如图1 所示ADC药物分子包含抗体、linker、小分子药物三个结构模块。
图1
毒性小分子药物通过linker与抗体偶联,Linker是ADC的重要组成部分。Linker有不同类型,例如腙(hydrazone)linker、二硫化物(disulfide)linker和断裂或非断裂的肽linker。这些linker释放活性毒性小分子药物的方式在体内有明显的不同。如图2所示,由于Linker的不同也导致ADC药物进入体内经过酶或者化学反应得到的代谢产物不同。
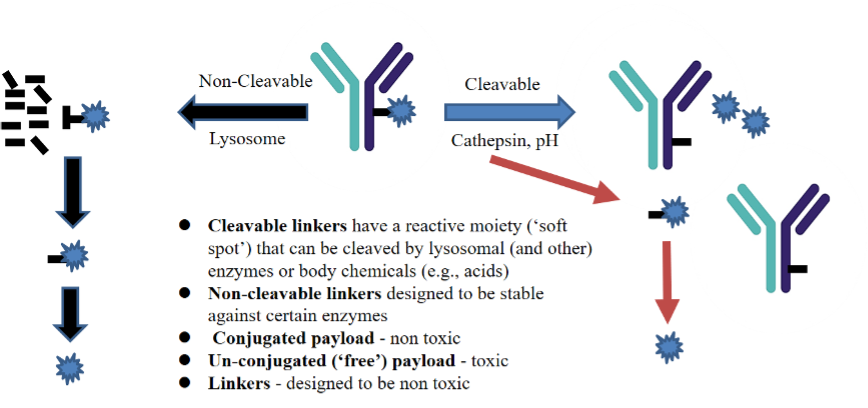
图2
生物分析在ADC药物开发中对于安全性和有效性的评价起着至关重要的作用。ADC独特而复杂的结构特征需要特殊的生物分析策略,这与应用于小分子外源性生物制剂和大分子生物制剂(如肽或治疗性蛋白制品)的分析策略不同。如图3所示,ADC生物分析的内容主要包括未偶联的毒性小分子药物,偶联的毒性小分子药物,ADC(即偶联的单克隆抗体),总毒性小分子药物,裸抗和总单克隆抗体。由于ADCs的复杂性,样品制备可能具有挑战性,因此应在ADC各个部分的生物分析工作流程中仔细考虑和执行样品制备。由于在之前公众号文章中已经分享了基于LC-MS检测抗体的相关方法,本章则主要描述不同的样品制备技术及其在未偶联的毒性小分子药物,偶联的毒性小分子药物定量分析中的应用。
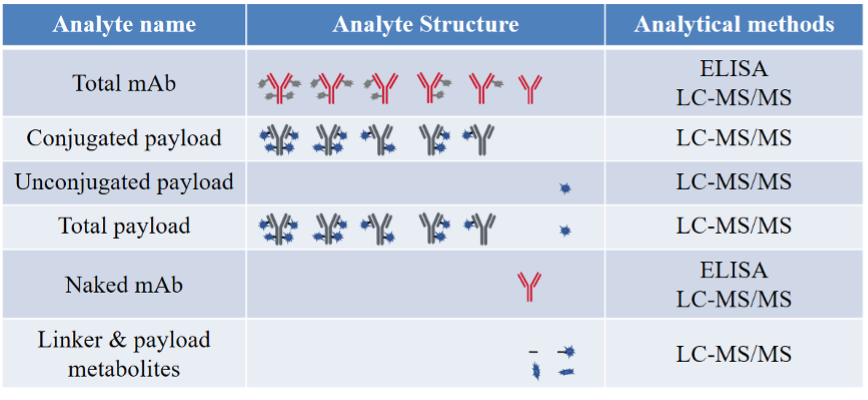
图3
非偶联毒性小分子药物
未偶联的毒性小分子药物包括给药后血浆或肿瘤组织中与活性药物解离的毒性小分子药物,以及活性药物制剂中残留的毒性小分子药物。
用于非偶联毒性小分子药物生物分析的样品提取方法如图4所示,其中包括蛋白质沉淀(PPT)、固相萃取(SPE)、液-液萃取(LLE)。由于基质中存在各种蛋白酶,采集后样品基质中未偶联的毒性小分子药物水平可能会由于样品稳定性问题导致游离小分子毒物浓度增加。因此,需要在样品采集完或提取前添加蛋白酶抑制剂混合物或在冰水浴中进行样品提取,以防止或最大限度地减少样品制备过程中来自ADC的毒性小分子药物解偶联。同时也需要考虑毒性小分子药物在基质中的稳定性。例如,DM1含有一个游离硫醇部分,可能会与血清中的其他含硫醇分子发生二聚或反应,样品可以使用还原剂TCEP进行处理,或者可以采用冰浴前处理,前处理试剂也需要提前预冷。由于ADCs属于靶向制剂,理想状态下在正常的组织或者部位不会释放出小分子毒物,因此给药后在健康受试者或动物模型中小分子毒物的浓度很低,对于我们在检测游离药物浓度的定量下限浓度要求就会设置很低,有可能会到pg级。一般的前处理方式可能无法满足我们的检测需求,通常在优化完液相质谱条件后,需要优化前处理方式,比如由蛋白沉淀改为液液萃取或者固相萃取等。
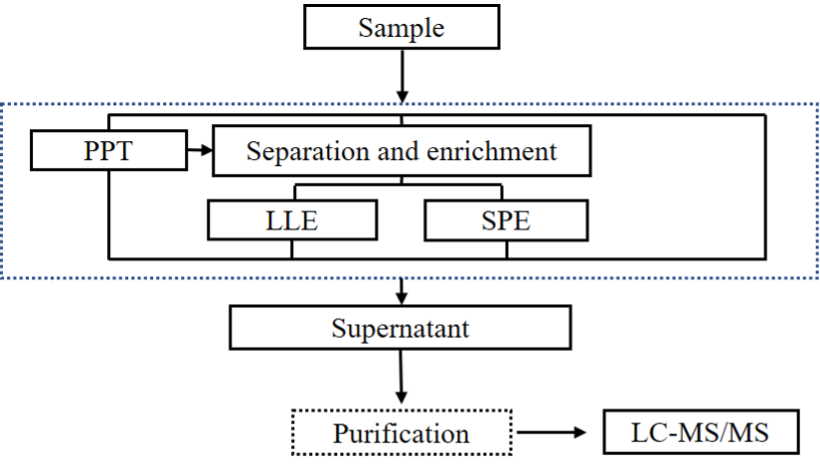
图4
偶联毒性小分子药物
偶联毒性小分子药物即为毒性小分子药物通过linker与抗体偶联。偶联毒性小分子药物需要根据linker的性质和类型(裂解型和非裂解型)决定前处理方式,从而释放出游离的毒性小分子药物进行检测。一般可以通过免疫亲和捕获或者根据ADCs与未偶联毒性小分子药物的亲水/疏水性质不同进行物理分离,从而使偶联毒性小分子药物与未偶联毒性小分子药物分开。然后依linker不同的性质或类型使用对应的处理方式将偶联毒物释放,最后通过LC-MS进行检测。
a)偶联毒性小分子药物(裂解型linker)
通常裂解型linker(腙,二硫键,肽链等)在细胞微环境中经过化学或者溶酶体蛋白酶的作用下释放出毒性小分子药物。例如,腙linker对pH敏感,在较低pH下,通过在包涵体和/或溶酶体等隔间中断裂释放活性毒性小分子药物;二硫键利用细胞内的还原环境释放毒性小分子药物;裂解型的肽linker被溶酶体蛋白酶酶切。在检测偶联毒性小分子药物时,首先需要从生物基质中将偶联毒性小分子药物和未偶联毒性小分子药物进行分离。常用的主要有免疫亲和捕获如图5所示,可以使用Biotin标记特异性单克隆抗体,使用链霉亲和磁珠进行提取,亦可采用Protein A或Protein G磁珠进行免疫亲和捕获。偶联毒性小分子药物分离结束后,根据Linker类型选择合适的裂解方式,例如加入还原剂DTT,或者使用组织蛋白酶进行裂解释放出毒性小分子药物,然后对样品进行进一步纯化处理,最后使用LC-MS进样分析。另外也可以使用物理方法,例如液液萃取或者固相萃取如图6所示,将疏水性游离的毒性小分子药物提取出来,再向样品中加入组织蛋白酶裂解释放毒性小分子药物用于LC-MS检测。
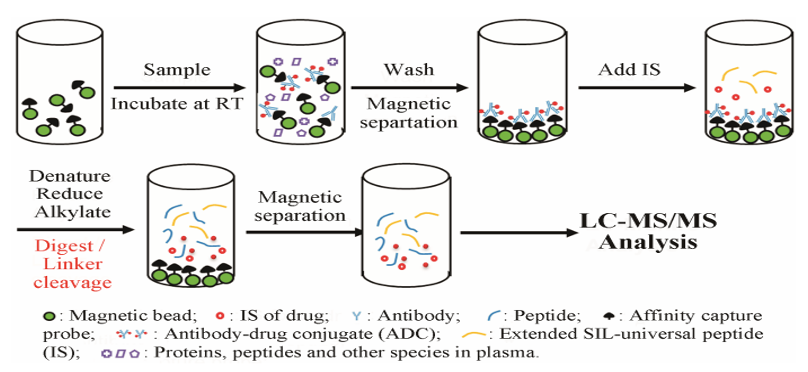
图5(Acta Pharmaceutica Sinica, 2016)
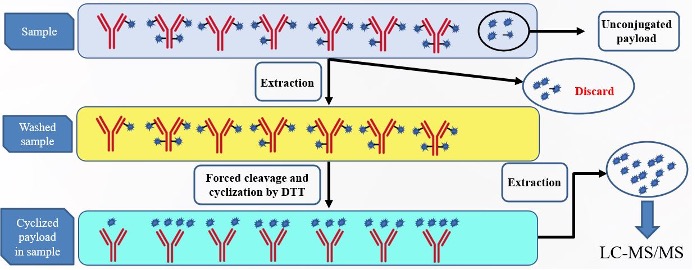
图6
b)偶联毒性小分子药物(非裂解型linker)
非裂解型Linker偶联的毒性小分子药物检测相对较为复杂,可能无法通过酶裂解释放出毒性小分子药物,一般会形成与肽偶联毒性小分子药物的样品混合物,通过检测替代肽偶联毒性小分子药物来反映偶联毒性小分子药物的浓度。因此当linker是酶非裂解型,在样品前处理过程中存在诸多挑战。首先,标准品不容易获得,因为标准品是毒性小分子药物与从抗体酶解的肽偶联,并且标准品通常需要毒性小分子药物与肽的额外偶联,这将根据偶联位点和蛋白酶在抗体中的切割位置而变化,此外混合毒性小分子药物试验还需要包括相应的内标(IS)。第二,毒性小分子药物和/或linker可以在不与循环中的抗体解偶联的情况下进行代谢,这将导致不同的分析物需要通过LC-MS/MS进行检测。理论上非裂解型Linker偶联的毒性小分子药物检测也可以通过亲和免疫捕获,其方法与裂解型Linker偶联的毒性小分子药物的方法相同,提取结束后加入还原剂TCEP/DTT破坏二硫键,加入碘乙酰胺保护二硫键,最后使用胰蛋白酶进行酶解后进样分析。
总结
由于ADC兼具了单克隆抗体药物高度特异性和靶向性的特点,以及小分子药物清除癌细胞的高效性,能协同发挥抗体药物和化学药物各自的优点,能够降低对生物系统的伤害。因此ADC药物研发异常火热,对于偶联技术、新型细胞毒素、药物负载提升等进行了创新,于此同时这也对生物分析也提出了新的挑战。但是亲和捕获LC-MS方法由于其自身的特点(开发周期段,特异性强,同时检测多个待测物)在进行ADC药物安全性和有效性的评价时,因此在检测偶联的毒性小分子药物,偶联的毒性小分子药物,ADC(即偶联的单克隆抗体),裸抗和总单克隆抗体应用也会越来越广。