




2025年9月,CAR-T领域的先驱Carl H. June和mRNA技术奠基人Drew Weissman等权威专家在Nature Reviews Drug Discovery中发表了综述《In vivo chimeric antigen receptor (CAR)-T cell therapy》,本文对综述部分内容进行了翻译和总结。
在过去三十年中,由于单克隆抗体、抗体-药物偶联物(Antibody–Drug Conjugates,ADC)、细胞因子、免疫细胞衔接器、DNA和RNA疫苗以及工程化T细胞治疗的进展,免疫治疗发生了重大的变化。其中,自体嵌合抗原受体(Chimeric Antigen Receptor,CAR)T细胞疗法——采集患者自身的T细胞,经遗传修饰以表达CAR并回输——因其良好的疗效而脱颖而出,在B细胞恶性肿瘤中显示出治愈潜力。尽管如此,但自体或同种异体 CAR-T细胞疗法扩展到更广泛的人群和适应症的速度比预期更慢。体内 CAR-T细胞治疗,利用慢病毒载体或脂质纳米颗粒等靶向递送系统,将编码 CAR 的遗传物质引入内源性T细胞,直接在患者体内生成CAR-T细胞。由于不需要体外操作和化疗预处理,体内CAR-T细胞疗法在血液肿瘤和系统性红斑狼疮等自身免疫性疾病中显示出广泛的应用前景。
作为免疫治疗的重要突破,自体 CAR-T 细胞治疗已在血液系统恶性肿瘤中展现治愈潜力,目前全球已批准针对CD19(如 Kymriah、Yescarta)和B细胞成熟抗原(B cell maturation antigen,BCMA,如 Abecma、Carvykti)等多款产品,累计治疗超过35,000 名癌症患者,在B细胞急性淋巴细胞白血病、非霍奇金淋巴瘤、多发性骨髓瘤中实现持续缓解。更多的证据也表明了在自身免疫性疾病中的治疗潜力,治疗后患者实现了“免疫重置”状态。此外,在没有长期靶向毒性和持久性CAR-T细胞存在的情况下即可实现持久缓解,治疗相关不良事件的分级和管理已得到充分认识和标准化。
尽管治疗效果优良,但是细胞治疗注射液制造复杂和物流要求高导致成本高昂、潜在治疗风险和临床获益有限等问题限制了体外CAR-T 细胞产品的商业化使用。体外CAR-T细胞治疗,需针对每位患者收集 T 细胞,体外进行基因改造并扩增,经物流运输,回输患者,难以实现规模化生产。美国仅约20%符合条件的淋巴瘤患者能获得相应的治疗。治疗过程中,患者需清淋化疗(如环磷酰胺 + 氟达拉滨)预处理,增加骨髓毒性。同时CAR-T注射后可能引发严重副反应,包括细胞因子释放综合征(Cytokine Release Syndrome,CRS) 、免疫效应细胞相关神经毒性综合征(Immune Effector Cell-associated Neurotoxicity,ICANS) 、免疫效应细胞相关噬血细胞性淋巴组织细胞增多症样综合征(Immune Effector Cell-associated Haemophagocytic Lymphohistiocytosis-like Syndrome,IEC-HS)。此外,受T细胞适应性和肿瘤内在因素,如肿瘤微环境抑制或靶标抗原低表达或异质性表达导致免疫逃逸等影响,许多患者无法获得持久的临床获益。
未来,体外细胞治疗致力于简化制造和物流流程,以提高患者可及性,特别是研发“现货通用”型产品。在血液系统恶性肿瘤中的应用有望从复发难治性疾病扩展到一线治疗和新诊断的高危患者,同时拓展应用于非B细胞血液系统癌症。在实体瘤中,致力于开发疗效更高、缓解更持久的细胞治疗产品。除肿瘤领域外,将应用于非肿瘤适应症,如自身免疫性疾病、再生医学和感染性疾病。
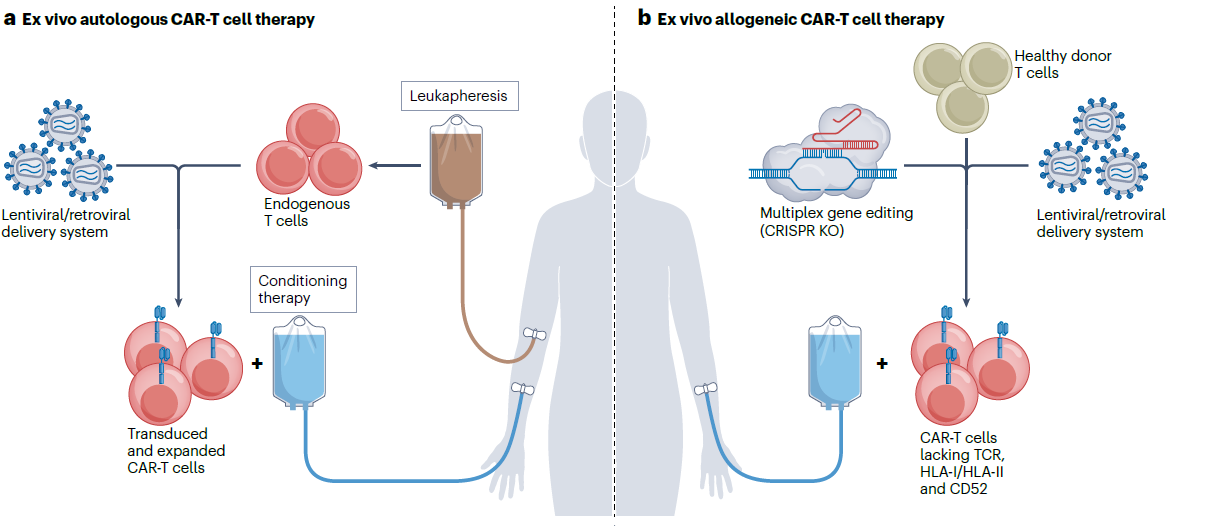
图1 体外自体/同种异体CAR-T细胞治疗
体内CAR-T细胞疗法无需体外细胞操作,患者输注含有表达CAR载荷的病毒载体或脂质纳米颗粒(lipid nanoparticle,LNP)制剂后,免疫细胞会被快速工程化,进而在微环境中识别并清除靶细胞。即利用“现成可用”的载体或制剂,在体内对免疫细胞进行直接原位CAR工程改造。体内细胞治疗方式需要利用患者体内已存在的免疫细胞,因此无需清淋预处理。慢病毒等载体经过工程化改造,可实现细胞靶向摄取或调节工程化免疫细胞的活性。CAR mRNA形式设计为瞬时发挥作用,限制了靶向活性的持续时间。然而,要实现足够高的药理活性,可能需要对其进行重复给药或优化。基于病毒的平台会使T细胞携带永久整合的CAR,而且这些T细胞可能在体内持续扩增和存在。
目前进入临床开发阶段主要有两类平台,其载荷和递送策略存在差异:一种是携带整合型载荷的工程化病毒载体,另一种是携带瞬时表达RNA的LNP。携带整合型载荷的体内CAR技术,通常使用慢病毒或γ-逆转录病毒,对病毒包膜进行改造,实现对T细胞的选择性摄取并促进CAR的载体向细胞质递送。改造后的免疫细胞群体根据抗原的存在和负荷,自行调节其扩增和存续,这在需要较高药效以实现临床疗效,如肿瘤适应症中可能具有优势。开发基于病毒的体内CAR-T细胞平台的公司包括Interius BioTherapeutics、Umoja Biopharma和EsoBiotec等。LNP-RNA的体内CAR-T技术,脂质体纳米颗粒由脂质组成,包括可促进RNA载荷从内体/溶酶体释放到细胞质中的可电离脂质。靶向性可通过向脂质中加入嗜性成分或抗体来源的结合剂实现。目前RNA形式主要有线性mRNA和环状RNA。相比之下,依赖瞬时表达、非整合型载荷的RNA技术则可通过调整给药方案,相对独立于抗原负荷来控制暴露(上调或下调CAR工程化免疫细胞的数量和存续),这在安全性要求更高的如自免类适应症中可能具有优势。开发该技术的公司包括Myeloid Therapeutics、Orna Therapeutics和Capstan Therapeutics等。
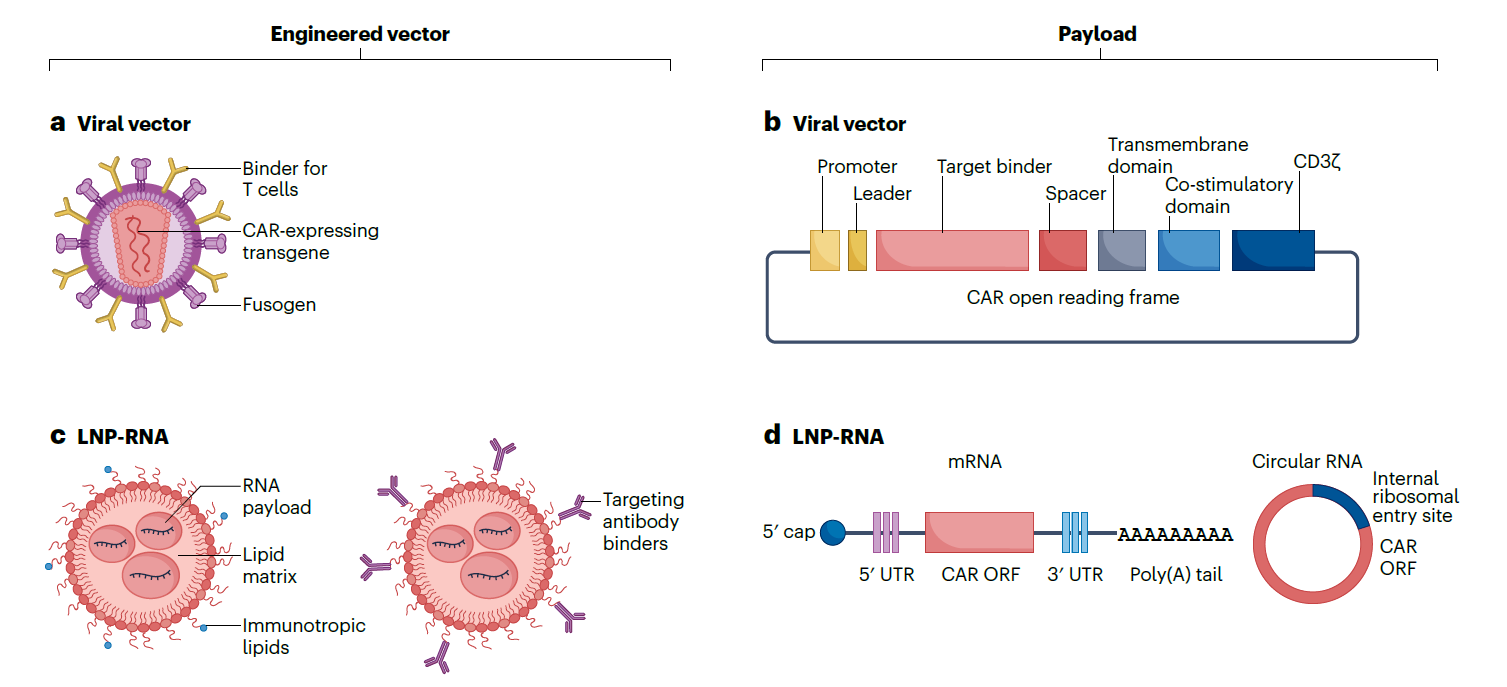
图2 主流体内CART平台
对于病毒载体的体内CAR-T细胞疗法,由于CAR序列在基因组中永久整合,部分患者可能出现 CAR-T 细胞活化、扩增、再扩增或持续存在的情况,进而引发CRS、ICANS或IEC-HS,针对 B 细胞的产品可能导致B细胞持续耗竭和低丙种球蛋白血症。病毒载体存在潜在遗传毒性和低概率克隆事件风险,需对患者进行长期监测,这可能影响该技术在安全性要求高如自免类适应症中的应用。针对某些病毒成分的免疫原性也可能影响该类产品的应用和重复给药。病毒载体整合可能导致插入突变,进而引发克隆事件,因此需对患者进行长期监测。
对于LNP-RNA的体内CAR-T疗法,由于该方法为瞬时工程化,可能需要重复给药以实现足够暴露,因此产品反应原性或免疫原性可能成为限制因素,因此该方式可能更适合疗效要求较低的适应症。由于其对肝脏和髓系细胞的趋向性,存在发生急性输注反应、肝脏毒性以及产品免疫原性导致过敏反应的可能性。若细胞选择性不佳,非靶细胞的联合工程化可能限制疗效或引发器官病理损伤。尽管可以调整药剂量,但仍不能排除出现药物作用加剧的情况。由于这类产品结合了纳米药物、RNA 分子和 CAR 产品,目前缺乏临床经验和安全性特征,因此在早期临床开发中需进行全面的风险监控。
大多数生物公司优先选择经过充分验证的靶点,以指导其平台技术的优化,从而实现临床转化和商业产品开发。通过替代或超越可扩展性较低的体外工程化细胞产品或疗效不佳的生物制剂,扩大 CAR 疗法的临床应用范围。在血液肿瘤领域,由于将免疫疗法推向早期治疗的理论依据充分,且微小残留病(Minimal Residual Disease,MRD)检测技术不断发展,在一线治疗中针对高危患者开展治疗是一个重要的机遇,以实现治愈目的。在自身免疫性疾病领域,关键目标是开发可扩展的疗法,实现 “免疫重置”—— 即深度免疫细胞谱系耗竭后,快速重建正常免疫细胞库,最终实现持久的无治疗缓解,且无组织或基因组后遗症。在再生医学领域,针对纤维化和衰老的重要机遇是,通过体内 CAR 工程化免疫细胞清除致病性细胞,恢复正常组织功能。
目前这些正进入临床的体内CAR-T技术,最终将实现载荷表达的时空可控性,并容纳多种协同作用机制。因此,它们将超越现有治疗方式的能力,在更广泛的疾病中实现更优的临床疗效。从体外到体内 CAR-T 细胞疗法的概念转变,重新定义了免疫疗法的可扩展性和可及性 —— 通过大幅降低生产成本,产生深远的社会经济影响,推动救命疗法的普及。
本篇内容系统地介绍了体内CAR-T细胞疗法的基本概念和技术平台,以及其在血液肿瘤、自身免疫病等领域的应用前景与挑战。下篇将为大家深入介绍体内CAR-T治疗的临床开发进展,敬请期待。
针对体内CAR-T的临床生物分析和生物标志物检测需求,熙宁|精翰生物可提供从PK/PD、免疫原性、安全性评估到探索性生物标志物的一站式检测服务,凭借其全平台技术能力、丰富细胞治疗项目经验、自主方法学与合规体系,为体内CAR-T的临床试验提供可靠的分析支持。欢迎您后台留言咨询。
参考文献:
[1] Bot A, Scharenberg A, Friedman K, et al. In vivo chimeric antigen receptor (CAR)-T cell therapy. Nat Rev Drug Discov. Published online September 30, 2025.
[2] Li YR, Zhu Y, Halladay T, Yang L. In vivo CAR engineering for immunotherapy. Nat Rev Immunol. 2025;25(10):725-744.