



系统性红斑狼疮(Systemic Lupus Erythematosus,SLE)是一种以广谱自身抗体沉积、多器官炎性损伤为特点,临床异质性显著的慢性自身免疫性疾病。SLE发病几乎累及人体各器官、组织和系统,临床表现复杂多样,好发于育龄期女性,女性发病年龄多为15~40岁,女:男约为7~9∶1。SLE的发病率和患病率在不同种族人群中具有一定差异,亚洲及太平洋地区SLE的每年发病率约为每10万人中有2.5~9.9个,每年患病率约为每10万人中有3.2~97.5个[1]。目前SLE已由既往的急性、高致死性疾病转为慢性、可控性疾病,但仍没有根治的方法。临床强调早发现、早干预、早治疗,治疗方式主要为对症治疗和防治感染,以达到控制疾病活动、缓解病情、避免或延缓不可逆的组织脏器的病理损伤等目的。
PART 01
SLE的发病机制
SLE发病机制复杂,且尚未完全阐明,目前仍认为是遗传、表观遗传、免疫、代谢、雌激素和环境因素等多因素综合作用的结果。
Toll样受体7(Toll-like receptor 7,TLR7)基因突变,导致TLR7选择性地增加对鸟苷和2',3'-cGMP的亲和力,使得TLR7活化增强,诱导SLE发病。该模型成功在小鼠体内引发狼疮,由此确认该基因是SLE的致病基因[2]。
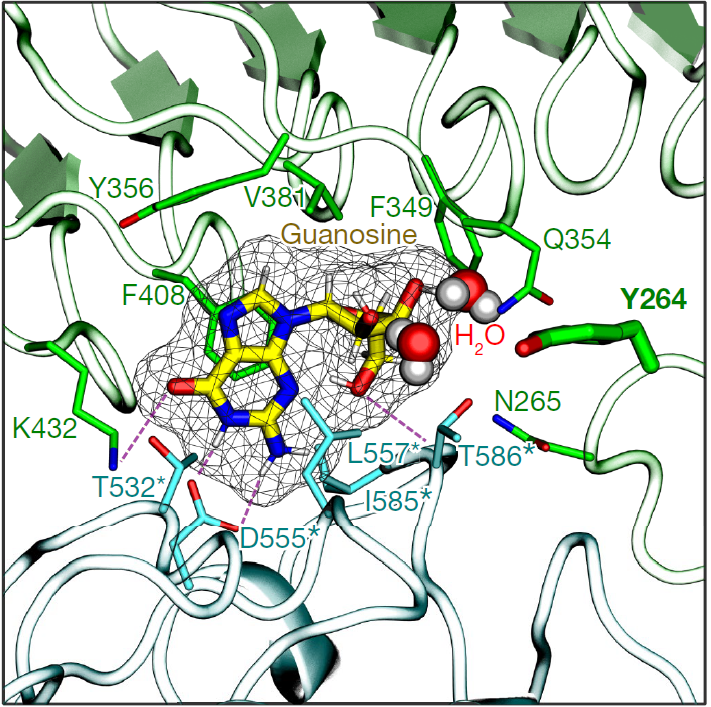
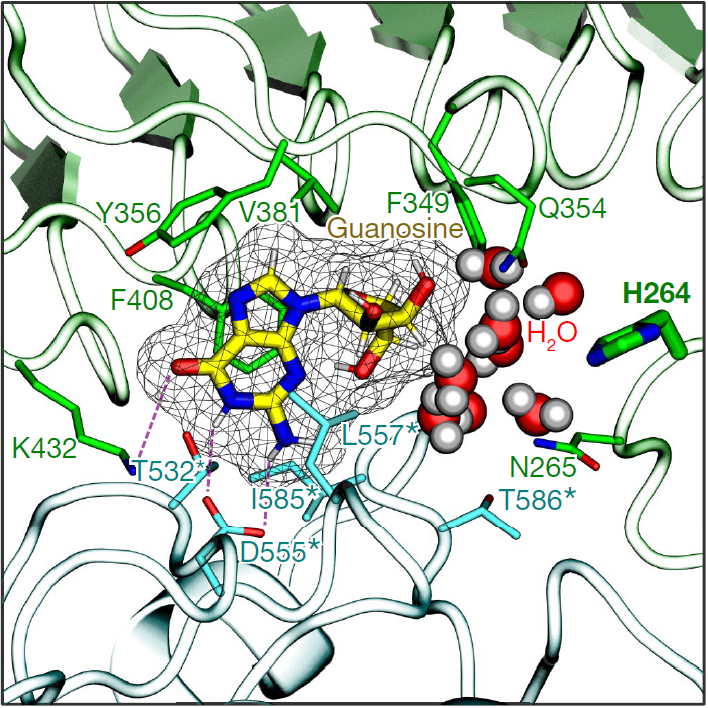
图1 TLR7结构图
注:左图为正常的TLR7结构图,右图为突变后的TLR7结构图。突变发生在位点Y264处,突变为H264。中心的网状区域结构为鸟苷,突变后的TLR7可以与鸟苷形成更多的氢键。根据分子动力学的模拟结果,这提升了二者之间的亲和力。
TLR7可以通过影响B细胞活化的两种途径,来诱使免疫系统产生自身反应性抗体分泌细胞,进而导致SLE的发生[3]。
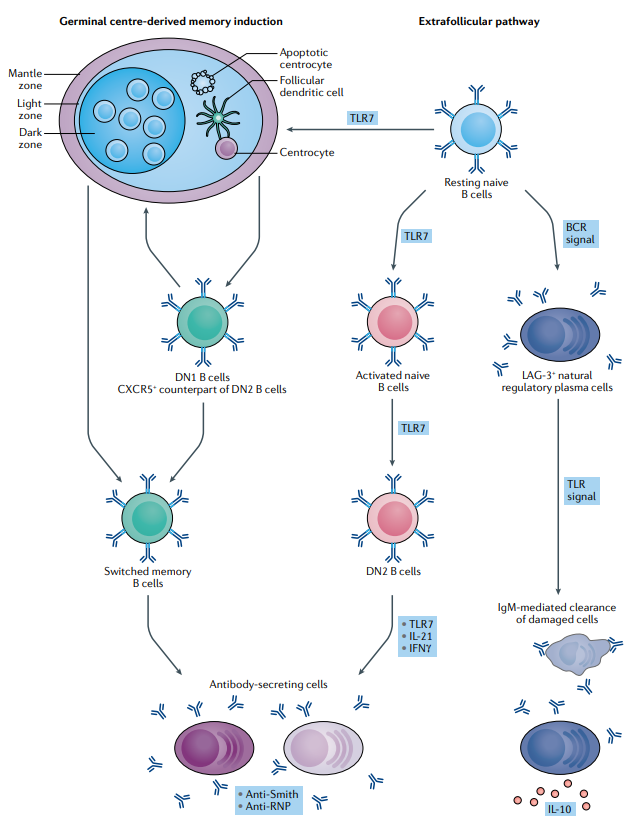
图2 TLR 通过不同的途径驱动SLE患者的浆细胞分化
Johanna K Sandling等人的研究表明,T细胞通路与SLE相关性最强,JAK-信号转导和转录激活因子(Signal Transducer and Activator of Transcription,STAT) 通路相关的基因突变,会导致人类白细胞抗原(Human Leukocyte Antigen, HLA)和IFN异常,进而增加SLE易感性[4]。除此以外,巨噬细胞、中性粒细胞、浆细胞样树突状细胞等免疫细胞也被认为与SLE患者的病理相关[5]。
50%~75%的SLE患者均存在IFN-Ⅰ升高或IFN调节基因表达的增加[6]。根据已有的研究证据所建立的SLE病理模型,靶器官内的干扰素Ⅰ可能有多种来源,可能决定了SLE的临床表型和对治疗的抵抗力。但是非循环、非造血系统所长期产生的IFN-Ⅰ,在SLE的发病和发展中起主导作用[7]。

图3 I型干扰素在SLE进展阶段的作用机制模型
PART 02
SLE的分类标准和评估方式
自从1982年,美国风湿病学会(ACR)正式发布系统性红斑狼疮(SLE)分类标准以来,至今已经40多年。在此期间,ACR于1997年修订了SLE标准[8];SLE国际临床协作组(SLICC)于2012年发布了SLE分类标准[9];20欧洲风湿病联盟(EULER)与ACR于2019年联合发布了SLE分类标准[10]。SLE分类标准的变迁,主要体现在:重视肾脏病理、重视免疫学指标、重视早期诊断和重视更新流行病方法学。目前,2019年EULAR与ACR联合发布的SLE分类标准的敏感度为96%,特异度为93%,是全球金标准。虽然上述分类标准的更新和优化表明学界对SLE的理解在逐步加深,免疫学检测方法在不断优化,但SLE分类标准终究只是分类标准,并不是决定患者个体诊断的标准,并未彻底突破其局限性[11]。
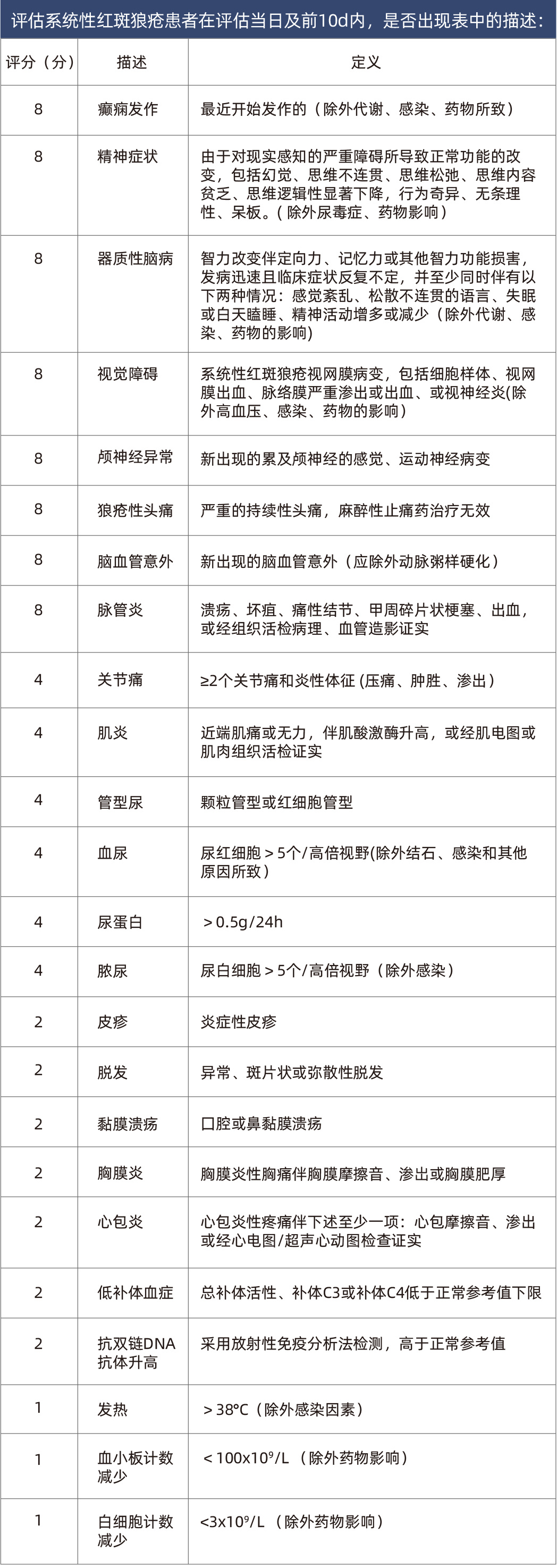
对于已确诊的SLE患者,临床需要定期对其SLE疾病活动度进行评估。目前常用的评估工具有:英国狼疮评估小组(BILAG-2004)、SLE疾病活动指数(SLEDAI-2000)、系统性红斑狼疮疾病活动度评分(SLE-DAS)[12]等。目前国内临床实践中,常采用SLEDAI-2000来对疾病活动度进行分级,再结合临床医师的整体判断(Physician Global Assessment,PGA),参照SLE患者的临床表现和其它表现对疾病活动度进行准确评估[13]。
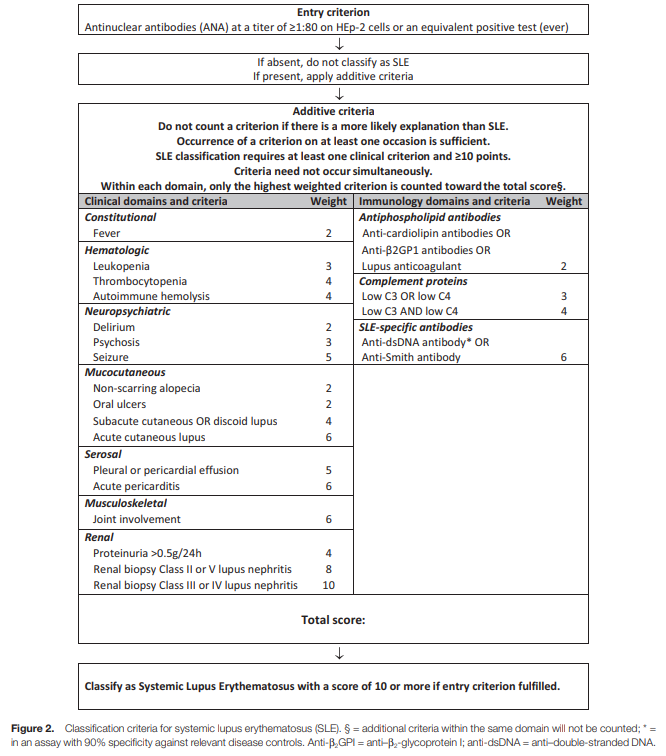
图4 2019年EULAR与ACR联合发布的SLE分类标准
表1 SLE疾病活动指数(SLEDAI-2000)评分表
PART 03
SLE相关生物标志物介绍
随着SLE的相关研究不断深入,免疫学异常越来越受到重视。在临床中,一旦患者出现免疫学异常,即使临床诊断不够确诊SLE的条件,也应密切随访,以便尽早做出诊断和及时治疗。
免疫学异常主要体现在抗核抗体方面。抗核抗体(ANA,Anti Nuclear Antibodies)是一组将自身真核细胞的细胞核、细胞浆、细胞骨架及细胞分裂周期蛋白等作为靶抗原的自身抗体的总称,并不是单一成分。ANA的性质主要是IgG,也有IgM、IgA和IgD,无器官和种属特异性,主要存在于血清中,也可存在于胸腔积液、关节滑膜液和尿液中。健康体检人群中ANA阳性率高达11.27%,大部分为生理性自身抗体[14]。抗核抗体检测包括抗核抗体总抗体的检测(后续以ANA代指)和针对靶抗原的特异性自身抗体检测(后续以抗核抗体谱或ANAs代指),二者各有不同的临床应用优缺点。ANA阳性常见于SLE患者,检测敏感性好,故ANA检测常用于SLE高危人群的筛查。由于受限于技术和对ANA的认知,目前抗核抗体谱所检测的特异性自身抗体仅占抗核抗体中的一小部分,因此抗核抗体谱的检测不如ANA检测全面,但其疾病特异性强,如抗Sm抗体,疾病特异性高达99%,且部分特异性自身抗体与疾病活动性密切相关,如抗双链DNA(dsDNA)抗体。故在临床应用中,ANA和抗核抗体谱的检测一般需要同时进行。
系统性红斑狼疮极易攻击患者肾脏,肾脏活检虽然是确诊狼疮肾炎的金标准,但不易定期检查。临床常采用检查患者的24小时尿蛋白含量或尿蛋白肌酐比等方式,来监测患者的肾脏功能。
除此以外,SLE患者还常出现类风湿因子(RF)和γ球蛋白升高、补体下降、凝血功能异常等现象。针对上述指标进行定期监测可以快速准确地对疾病进行分类和对病情进行评估。
随着病情的发展,SLE患者的心脏、肺脏、消化系统、血液系统、肾脏、神经系统等均会出现不同程度的损伤,甚至产生狼疮危象。故在疾病发展过程中,还应该对相关系统的生物标志物进行监测,及时对症治疗,避免病情加重,进入狼疮危象。
PART 04
ANA的检测方法
ANA的检测方法包括间接免疫荧光法(IIF法)、酶联免疫法(ELISA)、线性免疫印迹法(Line Immunoassay,LIA)、化学发光免疫分析法(Chemiluminescence Immunoassay, CLIA)、流式荧光发光法等多种免疫学方法[15]。但以HEp-2细胞为实验基质的IIF法是进行ANA检测的参考方法和首选方法,对SLE的诊断敏感性为95%,特异性为65%。如果临床高度怀疑SLE,而其他方法检测ANA结果为阴性时,必须采用IIF法重新检测ANA[16]。
间接免疫荧光法的检测原理是:先在生物载片的反应区上固定包被基质,即HEp-2细胞。随后将样品与生物载片共同孵育,样品中的抗核抗体(主要是IgG),与包被基质上的靶抗原相结合,形成结合在生物基质上的抗体-抗原复合物。经过反复清洗,去除未结合的样品后,加入荧光素标记的抗人抗体,一般为异硫氰酸荧光素(FITC)标记的羊抗人IgG,与结合在生物基质上的抗体-抗原复合物中的抗体端孵育反应,形成二抗-抗体-抗原免疫复合物。若样品中含抗核抗体,则形成的复合物上的FITC在荧光显微镜的488nm激发光激发下,会产生可被肉眼观察到的绿色荧光。若样品不含抗核抗体,则不形成免疫复合物,也不显示特异性荧光。
由于不同样品之间的抗核抗体组成不完全相同,其对应的靶抗原在细胞内的分布也不同,因此荧光产生位置不同,由此产生了不同的荧光模型。根据第2届ICAP 达成的共识[17]及我国ANA检测的临床实践现状,荧光模型分为3类:细胞核荧光模型(14种)、细胞浆荧光模型(9种)和细胞有丝分裂荧光模型(5种)。
除了特异性荧光模型外,抗体滴度也是该检测方法的判断结果之一。样品反应产生的特异性荧光会随着样品稀释倍数的提升而逐渐下降,直至消失。其中特异性荧光消失前的样品最大稀释倍数即是该样品的滴度。目前ANA滴度(量值)与疾病相关性无明确定论,但样品滴度值大于参考范围(标准为1:80)是SLE分类标准中的入组标准。
当前存在两种样品稀释方式,一种是传统倍比稀释系统,一般滴度汇报形式为1:40、1:80、1:160等;一种是10开方稀释系统,一般滴度汇报形式为1:100、1:320、1:1000等。我国临床ANA滴度检测与汇报现状较为复杂,上述两种稀释系统和滴度汇报形式常常相互混杂。但不同检测试剂在不同稀释系统下所得到的滴度值,不可以进行直接比较。一般来说,适用于10开方稀释系统的试剂,灵敏度更好,性能更优。
除此以外,目前间接免疫荧光法通常采用HEp-2细胞和灵长类肝脏冰冻组织切片两种基质,来联合检测患者样品中的ANA。一方面是由于SLE患者的ANA浓度较高,以HEp-2细胞为包被基质的检测方法抵抗Hook效应的能力较弱,极易产生假阴性的错误结果,从而影响临床判断。而灵长类肝脏组织切片由于种属差异性,可耐受极高浓度的ANA,进而辅助判断HEp-2细胞的结果是否正常(如组织切片为有强荧光,HEp-2为弱荧光或无荧光,则可能存在Hook效应,样品需要稀释后检测),从而扩充抗核抗体的可检测范围,显著提升检测方法的抗Hook效应干扰能力。另一方面是因为不同基质对于ANA中的特异性抗体的反应能力不同,比如抗SS-A抗体、抗SS-B抗体、抗着丝点抗体和抗增殖性细胞核抗原抗体在肝脏组织中产生的荧光显著弱于HEp-2细胞。根据此类差异,可以通过比较相同样品在两种基质中的差异,来高效地辅助判断荧光核型。
熙宁生物|精翰生物拥有丰富的血清或尿液样品,可提供与SLE相关生物标志物的检测方法开发、验证和样品分析经验,可提供抗核抗体滴度、抗核抗体谱、细胞因子、补体因子、补体溶血活性、血/尿生化、凝血功能、尿液自身抗体等一系列的药效学分析服务,欢迎后台留言咨询。
参考文献:
[1]Wang L , Wang F S , Gershwin M E .Human autoimmune diseases: a comprehensive update[J].Journal of Internal Medicine, 2015, 278(4):369-395.DOI:10.1111/joim.12395.
[2] Israeli E .TLR7 gain-of-function genetic variation causes human lupus[J].The Israel Medical Association journal: IMAJ, 2022(7):24.
[3] Fillatreau S , Manfroi B , Drner T .Toll-like receptor signalling in B cells during systemic lupus erythematosus.[J].Springer Science and Business Media LLC, 2021(2).DOI:10.1038/S41584-020-00544-4.
[4] Sandling J K , Pucholt P , Rosenberg L H ,et al.Molecular pathways in patients with systemic lupus erythematosus revealed by gene-centred DNA sequencing[J].BMJ Publishing Group, 2021(1).DOI:10.1136/ANNRHEUMDIS-2020-218636.
[5]李永珍综述,吴小川审校.2021—2022年度系统性红斑狼疮研究进展盘点[J].中国当代儿科杂志, 2023, 25(8):785-790.
[6] Fillatreau S .Antibodies against type I IFN: The bad guys self-restrain in systemic lupus erythematosus[J].Cell reports. Medicine, 2023(1).DOI:10.1016/j.xcrm.2022.100903.
[7] Antonios P , Miriam W , Edward M. V .Emerging concepts of type I interferons in SLE pathogenesis and therapy[J].Nature reviews. Rheumatology, 2022, 18(10):575-590.
[8] Hochberg M C .Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus.[J].Arthritis Rheum, 2010, 40(9):1725-1725.DOI:10.1002/art.1780400928.
[9] Petri M , Orbai A M ,Graciela S Alarcón,et al.Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus[J].Arthritis & Rheumatology, 2012, 64(8):2677-2686.DOI:10.1002/art.34473.
[10] Tedeschi S K , Johnson S R , Boumpas D T ,et al.Multicriteria decision analysis process to develop new classification criteria for systemic lupus erythematosus[J].Annals of the Rheumatic Diseases, 2019.DOI:10.1136/annrheumdis-2018-214685.
[11] Aringer, Martin, et al. “Advances in SLE Classification Criteria.” Journal of Autoimmunity, vol. 132, 2022, p. 102845.
[12]曾小峰,陈耀龙.2020中国系统性红斑狼疮诊疗指南[J].中华内科杂志, 2020(3):172-185.DOI:10.3760/cma.j.issn.0578-1426.2020.03.002.
[13]Diogo JesusAna MatosCarla HenriquesMargherita ZenMaddalena LarosaLuca IaccarinoJosé António Pereira Da SilvaAndrea DoriaLuís Sousa Inês.Derivation and validation of the SLE Disease Activity Score (SLE-DAS): a new SLE continuous measure with high sensitivity for changes in disease activity[J].Annals of the Rheumatic Diseases: A Journal of Clinical Rheumatology and Connective Tissue Research, 2019, 78(3).
[14]胡朝军,陈华,王立,等.体检人群中自身抗体筛查的临床意义[J]. 2014.DOI:10.3760/cma.j.issn.1009-9158.2014.11.012.
[15] Kumar Y , Bhatia A , Minz R W .Antinuclear antibodies and their detection methods in diagnosis of connective tissue diseases: A journey revisited[J].Diagnostic Pathology, 2009, 4(1, article 1):1.DOI:10.1186/1746-1596-4-1.
[16]胡朝军,周仁芳,张蜀澜.抗核抗体检测的临床应用专家共识[J].中华检验医学杂志, 2018(4).
[17]International consensus on ANA patterns (ICAP): the bumpy road towards a consensus on reporting ANA results[J].Autoimmunity Highlights, 2016, 7(1):1-8.DOI:10.1007/s13317-016-0075-0.