



水痘‑带状疱疹病毒(Varicella‑zoster Virus,VZV)初次感染后数天或数周内可在血清中检测到VZV特异性的抗体以及VZV特异性T细胞介导的免疫应答(VZV-Specific Cell‑Mediated Immunity,VZV‑CMI)[2]。其中VZV特异性抗体水平不会随着年龄的增长而下降,能有效预防水痘再次发生;而VZV-CMI对控制水痘-带状疱疹病毒至关重要,带状疱疹发病率与年龄相关性的VZV特异性CMI降低密切相关。老龄化、疾病或使用免疫抑制剂等因素,可导致VZV‑CMI水平下降,并成为带状疱疹发生的重要条件。研究证实[3],VZV-CMI随着年龄的增长而降低,接种带状疱疹疫苗/主动免疫可提高VZV-CMI,从而降低疫苗接种者感染带状疱疹的频率或严重程度。
在带状疱疹疫苗临床研究中,除了预防带状疱疹(Herpes Zoster, HZ)及其并发症带状疱疹后神经痛(Post-herpetic Neuralgia, PHN)的保护效力是疫苗的主要有效性指标,免疫原性指标也是疫苗研究中的重要有效性指标。其中,VZV特异性抗体及VZV-CMI是评价带状疱疹疫苗免疫原性的两个重要指标。CDE发表在中国新药杂志上的文章《带状疱疹预防用疫苗临床评价的考虑》[4]提到,早期临床试验(I-II期)除了初步评价疫苗的安全性和耐受性以外,同时尽可能获得免疫原性数据,为选择免疫程序和剂量提供依据。文中建议进行免前抗体水平检测,以充分评估基线感染状态,必要时根据免前抗体水平对免后免疫原性进行分层分析。对于创新型疫苗必要时应考虑检测抗原特异性T 细胞反应(VZV-CMI)及相关的细胞因子指标等。在III期确证性临床试验也应该包括免疫原性指标与保护的相关性研究、与已上市同类疫苗的免疫原性比较研究等。此外,文中还建议在整体临床研发计划时一并考虑对免疫原性持久性进行评价。
PART 01
VZV疫苗体液免疫评价
GSK公司的Shingrix/欣安立适(HZ/su)是一种含佐剂的重组带状疱疹疫苗,在 50岁及以上成年人中有≥90%的HZ保护率[5],由VZV糖蛋白E(gE)抗原和AS01B佐剂系统组成,其中gE蛋白能够诱导产生中和抗体和CD4 T细胞反应,AS01B佐剂系统包括 QS-21和 MPL,能够刺激局部短暂的先天免疫反应,导致抗原呈递的树突状细胞的募集和激活。作为TLR4的激动剂,MPL与QS-21协同作用,通过IFN-γ的产生增强对共同接种抗原的免疫反应[6]。
在Shingrix的临床研究中,免疫原性的评价指标包括体液免疫和细胞免疫。其中,体液免疫检测的是血清anti-VZV antibody和anti-gE antibody水平,体液免疫的响应被定义为在接种第一剂疫苗前具有可检测滴度的受试者中,几何平均浓度(Geometric Mean Concentration,GMC)增加至少4倍。
ZOE-50和ZOE-70是HZ/su的两项关键性III期临床试验[7],受试者(ZOE-50:50岁及以上;ZOE-70:70岁及以上)接种两剂HZ/su疫苗或安慰剂,两剂间隔2个月。在免疫原性子集中,检测血清中anti-gE抗体和CD4+ T细胞在gE肽段刺激后的免疫反应,以评估体液(n = 3293)和细胞介导(n = 466)的免疫原性(图1)。值得注意的是,在接种前,超过99%的受试者血清中检测到anti-gE抗体阳性,疫苗组和安慰剂组的anti-gE GMCs相当。安慰剂组受试者在接种后的任何时间点,anti-gE GMCs均无显著变化。疫苗组受试者接种第2剂HZ/su 1个月后,97.8%接受者达到了体液响应的标准(≥4倍增加),而安慰剂组只有2.0%。在第2剂接种后1个月观察到平均峰值反应。疫苗组的体液反应率随时间增加而下降,在接种后36个月为77.1%。在所有年龄组中,接种第2剂HZ/su后1个月的体液反应率相当,但是在接种后的12、24和36个月,老年组(≥70岁)的反应率略低。总的来说,在50岁及以上的HZ/su接受者中,anti-gE抗体的GMCs分别在接种第2针后1个月和36个月时,比基线水平增加了39.1倍和8.3倍。在接种后任何时间点,不同年龄组之间的anti-gE抗体GMCs差异极小。
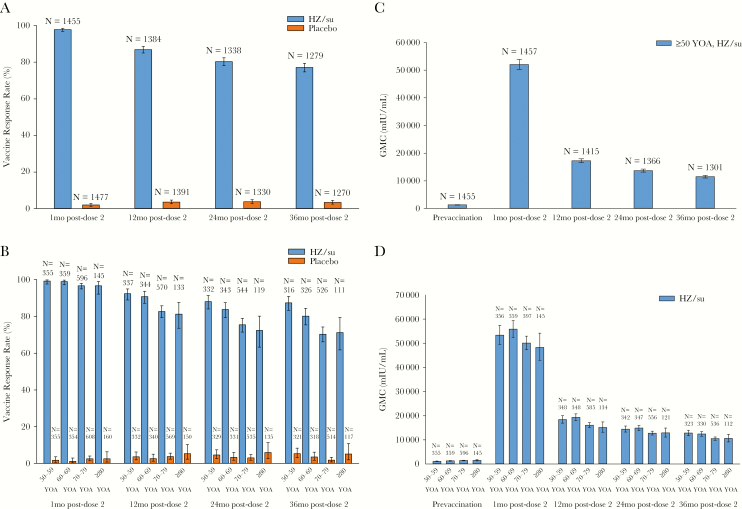
图1 Shingrix诱导的anti-gE抗体反应(符合协议的体液免疫原性队列):总体响应者百分比(A)、按年龄分组的响应者百分比(B)、总体几何平均浓度(GMCs)(C)、按年龄分组的GMCs(D)[7]
在一项II期研究(NCT00434577)[8]中,研究者评估了60岁及以上成年人接种不同配方的gE疫苗后的安全性和免疫原性,其中包括已获批上市的RZV配方(即Shingrix)。随后,也对接受2剂已获批的RZV配方(即Shingrix)的参与者在接种后4年、5年和6年(NCT01295320)[9]以及9年[10]和10年(NCT02735915)[11]进行免疫原性持久性的随访。
如图2所示,所有接受2剂次gE/AS01B配方的受试者,其anti-gE抗体的GMCs显著高于仅接种1剂次100μg gE/AS01B或接种2剂gE/生理盐水的受试者。在整体人群和≥70岁年龄层中,接受2剂次25μg gE/AS01B受试者的GMCs低于接受2剂次50 μg或100 μg gE/AS01B的GMCs。相比之下,50 μg和100 μg gE/AS01B组之间GMCs水平相当。在60至69岁的受试者中,接受2剂100 μg gE/AS01B受试者的GMCs高于25μg和50μg gE/AS01B的受试者。所有人群从接种后的第3个月到第36个月,GMCs有所下降,但仍然高于接种前的水平。所有接受2剂含佐剂疫苗的受试者在第36个月的anti-gE GMCs相比基线水平,有超过5.4倍的增加。对于anti-VZV的体液反应,观察到的结果与anti-gE相似。
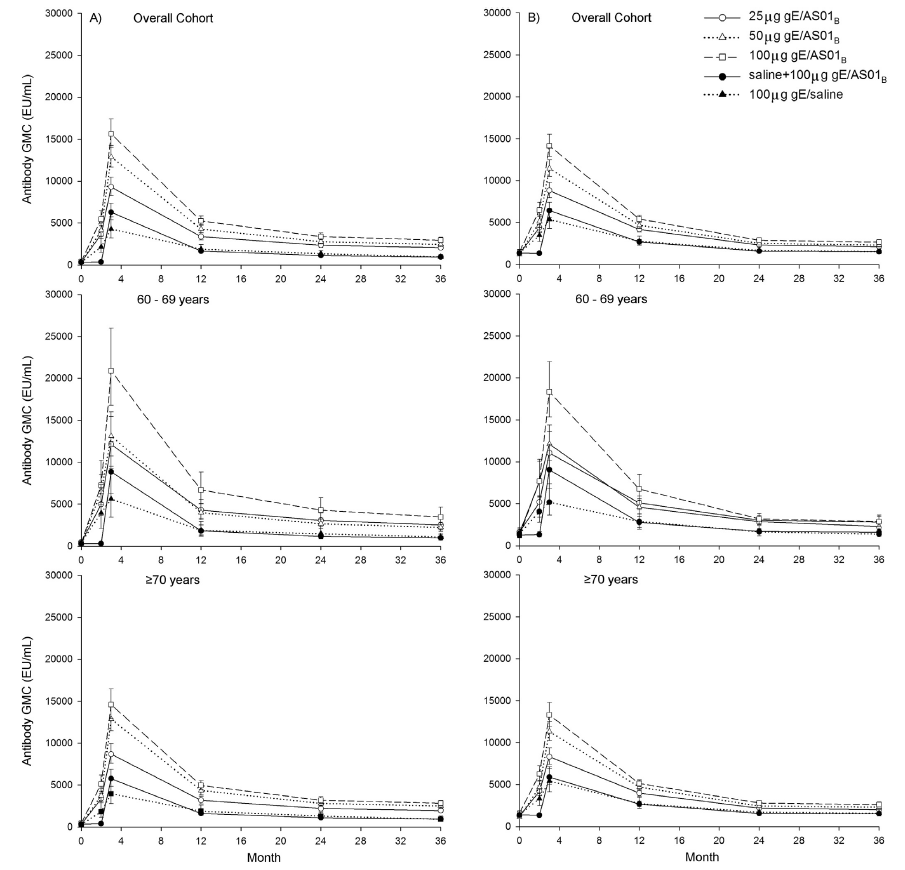
图2 不同配方的gE/AS01B诱导的anti-gE抗体(A)和anti-VZV抗体浓度(B)[8]
对于接种已获批RZV配方(50 μg gE/AS01B)疫苗的人群[11],在接种前anti-gE抗体的几何平均浓度(GMC)为1240 mIU/mL(95%置信区间,1003–1535),在接种第2剂后的1个月达到峰值,为43100 mIU/mL(95%置信区间,38252–48564 mIU/mL),从第4个月开始趋于稳定。随访至第108个月和第120个月时,anti-gE GMC仍有9123 mIU/mL(95%置信区间,7775–10704 mIU/mL)和7384 mIU/mL(95%置信区间,6203–8790 mIU/mL),表明Shingrix可诱导持续的体液免疫反应(图3)。
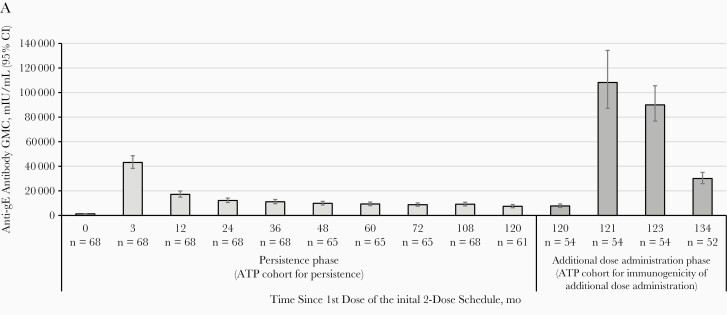
图3 接种2剂Shingrix后的10年内anti-gE抗体的几何平均浓度(GMCs)[11]
PART 02
VZV疫苗细胞免疫评价
Shingrix的临床试验中,gE特异性的细胞介导免疫(CMI)反应通过细胞内细胞因子染色(intracellular cytokine staining,ICS)方法测量,评估表达以下两种以上激活marker的CD4 T细胞的频率(简称CD42+): IFN-γ、IL-2、TNF-α和CD40L。CMI反应的cut-off值被定义为与免前相比,CD42+ T细胞的频率增加了至少2倍(对于接种前CD42+ T细胞频率高于每106个计数的CD4 T细胞中有320个阳性细胞阈值的参与者),或者比阈值增加了至少2倍(对于接种前频率低于阈值的参与者)[7]。I期和II期临床试验[12]表明,单剂量的HZ/su疫苗能够引发显著的CMI反应,在接种第二剂后进一步增强。两个关键的III期临床试验(ZOE-50和ZOE-70)[7]的免疫原性分析结果显示(图4、图5),疫苗组和安慰剂组在免前的gE特异性CD42+ T细胞频率中位数是相似的。在安慰剂接受者中,接种后gE特异性CD42+ T细胞频率没有显著变化,而HZ/su接受者的CMI在接种第二剂后1个月的反应率为93.3%。HZ/su接受者的CMI反应率在接种第二剂后的12个月下降到57.2%,在36个月时保持稳定。在接种后的12个月、24个月和36个月,70岁及以上的HZ/su接受者的CMI反应率略低于70岁以下的HZ/su接受者。总的来说,在50岁及以上的HZ/su疫苗接种者中,接种第二剂后1个月,gE特异性CD42+ T细胞的频率中位数比基线增加了24.6倍。接种后12个月,CD42+ T细胞的增加倍数有所下降,但之后保持稳定。在长期跟踪随访研究(ZOE-LTFU)[13]中,直到第10年,gE特异性CD42+ T细胞反应保持稳定,是接种前水平的6倍以上(图6)。
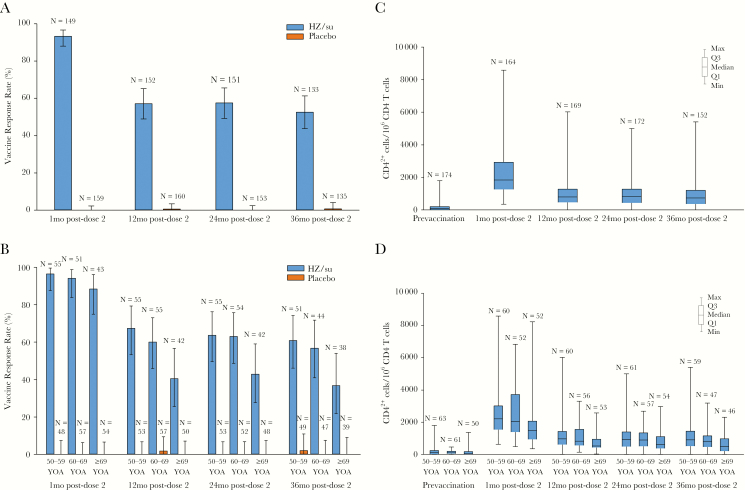
图4 Shingrix诱导的gE特异性细胞介导免疫 [7]

图5 CD4+ T细胞表达任意组合免疫marker的频率:多功能性CD4+ T细胞频率总体情况(A),按年龄组别的多功能性比例(B),以及整体激活marker组合(C)[7]
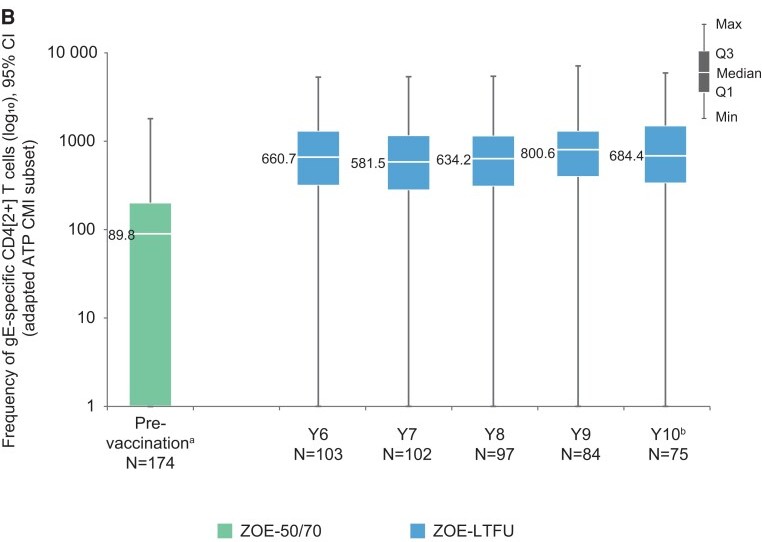
图6 Shingrix诱导的gE特异性细胞免疫反应的长期随访 [13]
PART 03
小结
熙宁生物|精翰生物以分析科学为核心能力,为新药临床与临床前研究提供专业技术服务。熙宁生物|精翰生物在疫苗临床研究领域具备完善的检测平台,可以提供一站式检测服务:基于ELISA、MSD、Fluorescence、Luminescence可提供高通量的结合抗体、中和抗体检测,基于ELISpot、ICS细胞免疫检测可支持中美、中澳、多中心、大样本量的临床试验等。
熙宁生物|精翰生物在带状疱疹疫苗临床研究领域具有丰富的项目检测经验,可提供一体化、高效率的临床生物分析服务,包括gE、gB等抗原的结合抗体检测、VZV中和抗体检测,以及基于ICS、ELISPOT方法的细胞免疫检测,高效助力贵司带状疱疹疫苗的临床研究,欢迎大家后台留言咨询交流。
参考文献:
[1] 中国医师协会皮肤科医师分会带状疱疹专家共识工作组, 国家皮肤与免疫疾病临床医学研究中心. 中国带状疱疹诊疗专家共识(2022版) [J] . 中华皮肤科杂志, 2022, 55(12) : 1033-1040. DOI: 10.35541/cjd.20220608.
[2] 中国医疗保健国际交流促进会皮肤科分会, 中华医学会皮肤性病学分会老年性皮肤病研究中心. 带状疱疹疫苗预防接种专家共识 [J] . 中华医学杂志, 2022, 102(8) : 538-543. DOI: 10.3760/cma.j.cn112137-20210828-01958.
[3] Oxman MN. Immunization to reduce the frequency and severity of herpes zoster and its complications. Neurology. 1995 Dec;45(12 Suppl 8):S41-6. doi: 10.1212/wnl.45.12_suppl_8.s41.
[4] 陈艳, 刘亚琳, 贾培媛, 李英丽, 高晨燕.带状疱疹预防用疫苗临床评价的考虑 [J]. 中国新药杂志, 2021, 30(19), 6. DOI:10.3969/j.issn.1003-3734.2021.19.012.
[5] Lal H, Cunningham AL, Godeaux O, Chlibek R, Diez-Domingo J, Hwang SJ, Levin MJ, McElhaney JE, Poder A, Puig-Barberà J, Vesikari T, Watanabe D, Weckx L, Zahaf T, Heineman TC; ZOE-50 Study Group. Efficacy of an adjuvanted herpes zoster subunit vaccine in older adults. N Engl J Med. 2015 May 28;372(22):2087-96. doi: 10.1056/NEJMoa1501184.
[6] Coccia M, Collignon C, Hervé C, Chalon A, Welsby I, Detienne S, van Helden MJ, Dutta S, Genito CJ, Waters NC, Deun KV, Smilde AK, Berg RAVD, Franco D, Bourguignon P, Morel S, Garçon N, Lambrecht BN, Goriely S, Most RV, Didierlaurent AM. Cellular and molecular synergy in AS01-adjuvanted vaccines results in an early IFNγ response promoting vaccine immunogenicity. NPJ Vaccines. 2017 Sep 8;2:25. doi: 10.1038/s41541-017-0027-3. Erratum in: NPJ Vaccines. 2018 Mar 21;3:13. doi: 10.1038/s41541-018-0047-7.
[7] Cunningham AL, Heineman TC, Lal H, Godeaux O, Chlibek R, Hwang SJ, McElhaney JE, Vesikari T, Andrews C, Choi WS, Esen M, Ikematsu H, Choma MK, Pauksens K, Ravault S, Salaun B, Schwarz TF, Smetana J, Abeele CV, Van den Steen P, Vastiau I, Weckx LY, Levin MJ; ZOE-50/70 Study Group. Immune Responses to a Recombinant Glycoprotein E Herpes Zoster Vaccine in Adults Aged 50 Years or Older. J Infect Dis. 2018 May 5;217(11):1750-1760. doi: 10.1093/infdis/jiy095.
[8] Chlibek R, Smetana J, Pauksens K, Rombo L, Van den Hoek JA, Richardus JH, Plassmann G, Schwarz TF, Ledent E, Heineman TC. Safety and immunogenicity of three different formulations of an adjuvanted varicella-zoster virus subunit candidate vaccine in older adults: a phase II, randomized, controlled study. Vaccine. 2014 Mar 26;32(15):1745-53. doi: 10.1016/j.vaccine.2014.01.019.
[9] Himal Lal, Roman Chlibek, Karlis Pauksens, Tino F. Schwarz, Jan H. Richardus, Gini G. C. Van Rijckevorsel, Thomas C. Heineman, Grégory Catteau, Persistence of the Immune Response to an Adjuvanted Herpes Zoster Subunit Vaccine in Healthy Older Adults: Modeling of Vaccine-Induced Immune Response, Data From a 6-Year Follow-Up Study, Open Forum Infectious Diseases, Volume 2, Issue suppl_1, December 2015, 1931, https://doi.org/10.1093/ofid/ofv133.1478
[10] Schwarz TF, Volpe S, Catteau G, Chlibek R, David MP, Richardus JH, Lal H, Oostvogels L, Pauksens K, Ravault S, Rombo L, Sonder G, Smetana J, Heineman T, Bastidas A. Persistence of immune response to an adjuvanted varicella-zoster virus subunit vaccine for up to year nine in older adults. Hum Vaccin Immunother. 2018 Jun 3;14(6):1370-1377. doi: 10.1080/21645515.2018.1442162.
[11] Hastie A, Catteau G, Enemuo A, Mrkvan T, Salaun B, Volpe S, Smetana J, Rombo L, Schwarz T, Pauksens K, Hervé C, Bastidas A, Schuind A. Immunogenicity of the Adjuvanted Recombinant Zoster Vaccine: Persistence and Anamnestic Response to Additional Doses Administered 10 Years After Primary Vaccination. J Infect Dis. 2021 Dec 15;224(12):2025-2034. doi: 10.1093/infdis/jiaa300.
[12] Leroux-Roels I, Leroux-Roels G, Clement F, Vandepapelière P, Vassilev V, Ledent E, Heineman TC. A phase 1/2 clinical trial evaluating safety and immunogenicity of a varicella zoster glycoprotein e subunit vaccine candidate in young and older adults. J Infect Dis. 2012 Oct;206(8):1280-90. doi: 10.1093/infdis/jis497.
[13] Strezova A, Diez-Domingo J, Al Shawafi K, Tinoco JC, Shi M, Pirrotta P, Mwakingwe-Omari A; Zoster-049 Study Group. Long-term Protection Against Herpes Zoster by the Adjuvanted Recombinant Zoster Vaccine: Interim Efficacy, Immunogenicity, and Safety Results up to 10 Years After Initial Vaccination. Open Forum Infect Dis. 2022 Oct 23;9(10):ofac485. doi: 10.1093/ofid/ofac485.