



【概况】
重组腺相关病毒(rAAV)是基因治疗关键的病毒载体,该病毒载体开发中主要挑战来自大规模生产的上游与下游的工艺优化和检测方案的标准化,其中重组腺相关病毒(rAAV)基因组拷贝数的精确滴定与临床前和临床环境中正确给药剂量直接相关,建立标准、准确和可重复的重组腺相关病毒(rAAV)基因组拷贝数定量的方法是基因治疗产品中工艺开发和优化的重要环节。已有报道的,实时荧光定量PCR(qPCR)技术用于重组腺相关病毒(rAAV)基因组拷贝数的滴定检测存在标准品建立复杂和定量重复性差的问题,数字PCR(dPCR)技术作为一种新型PCR技术,可直接定量重组腺相关病毒(rAAV)基因组拷贝数、无需依赖标准品和标准曲线,对抑制物耐受程度高,尤其适用于未纯化的病毒裂解样品的定量检测。
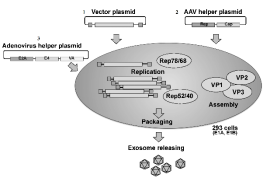
Fig1、重组腺相关病毒(rAAV)的生产
(1)将带有目的基因序列的ITR 侧翼表达载体质粒与(2)携带rep-cap基因的AAV包装质粒和(3)腺病毒辅助质粒共转染HEK-293细胞时,AAV载体的生产效率与使用腺病毒感染时一致。
【实验目的】
我们利用Naica数字PCR技术对重组腺相关病毒(rAAV)质粒载体和病毒基因组中ITR(CY5标记)、EGFP(GOI,HEX标记)和转录相关调控元件WPRE(FAM标记)三个不同基因位点同时拷贝数定量的方法进行优化,在数据分析中对不同病毒样品的前处理方案的条件进行阐述和比较,发现病毒样品的前处理方案中ITR发卡结构的线性化和衣壳蛋白的裂解条件对病毒基因组拷贝数定量的精确性影响尤为重要,为数字PCR方法在基因治疗病毒载体的质量控制体系中建立标准的检测方法提供依据。
【rAAV病毒基因组拷贝数滴度的定量检测方案】
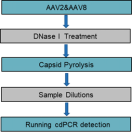
Fig2、cdPCR方法检测rAAV基因组拷贝数滴度的流程示意图
我们针对rAAV病毒载体进行了三重靶基因同时检测,包括:a. rAAV病毒通用检测位点ITR基因(CY5标记),b. EGFP(GOI)基因(HEX标记)用于rAAV滴度定量检测,c. 转录相关调控元件WPRE基因(FAM标记),可用于协助EGFP(GOI)基因定量准确性的评估。同时三重靶基因检测对rAAV质粒载体拷贝数定量、rAAV常用血清型rAAV2和rAAV8的病毒基因组拷贝数定量。
我们选用和元生物(OBiO)生产的rAAV2和rAAV8两种血清型病毒样品,在rAAV病毒样品前处理阶段,首先对rAAV2和rAAV8病毒颗粒进行DNase I消化处理,然后使用不同的热裂解条件对rAAV病毒衣壳蛋白进行裂解,在使用两种不同的稀释液对rAAV病毒裂解样品进行梯度稀释(Fig1),后续将梯度稀释的待测样品加入cdPCR反应体系中,使用cdPCR系统进行拷贝数定量(Fig2)。
由于rAAV病毒末端两个ITR区域是反向互补序列,会形成发卡状的二级结构,影响引物和探针的结合,我们选择使用Msp I限制性内切酶处理。在已报道的检测方法中,需要在数字PCR反应前对病毒基因组进行酶切预处理。由于cdPCR系统基于Crystal微滴技术即“微晶”微滴技术,允许直接添加限制性内切酶混合于cdPCR反应体系中,经过微滴生成步骤即可完成酶切反应,节省对病毒载体样品的处理时间。
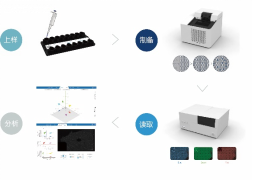
Fig3、cdPCR系统检测流程
cdPCR采用创新型微流控设计的2D微滴矩阵技术即Crystal微滴技术作为整个系统的核心技术理念,Opal高通量芯片做为专用的耗材,可单一样品生成和读取约20000个微滴数,仅需一步法上样将PCR预混液加入Opal芯片中即可完成从微滴生成、PCR扩增和三色荧光分析的整个实验流程,全程仅需2个半小时。结合Crystal miner智能可视化的图像分析软件,获得卓越的置信水平和真实可信的数据结果(Fig3)。
【结果】
cdPCR检测质粒样品进行概念验证
通过阳性对照质粒标准品进行概念验证,测试三重引物和探针的使用性能,根据线性化质粒定量检测的结果显示,WPRE(Fig4A)和EGFP (Fig4B)阴阳性微滴群的区分度良好,但是ITR(Fig4C) 阴阳性微滴群的区分度不好,存在雨滴现象,可能是受到ITR发卡状二级结构影响,随后我们在cdPCR反应体系中加入Msp I限制性内切酶用于切割ITR发卡结构,结果显示酶切后阴阳性微滴群的区分度得到极大改善(Fig4D)。经Msp I酶切后ITR拷贝数定量也比酶切前更接近于理论值(Fig5)。

Fig4、cdPCR检测WPRE/EGFP/ITR 三靶标1D散点图
A图显示WPRE检测的1D散点图,B图显示EGFP检测的1D散点图,C图显示Msp I酶切处理前ITR检测的1D散点图,D图显示Msp I酶切处理后ITR检测的1D散点图,蓝色表示WPRE阳性微滴群,绿色表示EGFP阳性微滴群,红色表示ITR阳性微滴群,灰色表示阴性微滴群。
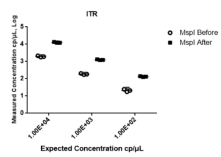
Fig5、Msp I酶切前后ITR基因绝对定量拷贝数值
上图空心圆圈代表Msp I酶切前的数据;实心方块代表Msp I酶切后的数据;横线代表CI at 95%下的平均值mean。
接下来对梯度稀释的线性化质粒样品进行定量检测,结果表明cdPCR定量结果和理论值一致性较高,三个靶基因测量R2均接近1(Fig6)。对于4个批次内及批次间样本检测结果分析(表1),cdPCR定量数据均表现出良好的重复性,变异系数最大值小于5.46%。

Fig6、cdPCR检测三个靶标基因测量值和理论值的一致性
A图显示WPRE基因;B图显示EGFP基因;C图显示ITR基因。图中竖线代表error bar。
表1 cdPCR对4个批次质粒样品的定量检测结果的一致性分析

cdPCR测试不同稀释液对病毒滴度的影响
分别使用稀释液A和稀释液B稀释处理rAAV2和rAAV8病毒样品,并进行三梯度线性检测EGFP(GOI)基因(Fig7),结果显示两种稀释液的定量数据无明显差异。
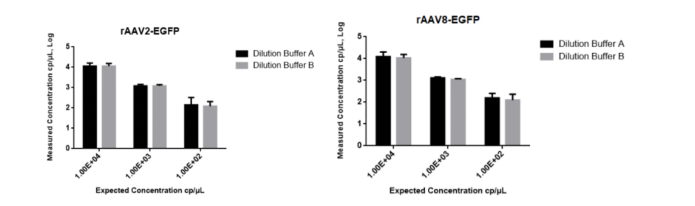
Fig7、不同稀释液对rAAV EGFP基因定量检测结果的影响
图中黑色方块代表稀释液A,灰色方块代表稀释液B,横线代表CI at 95%下的平均值(n=3)。
cdPCR检测不同的热裂解时间对rAAV病毒基因组拷贝数定量的影响
为了探讨rAAV病毒衣壳蛋白热裂解时间对定量结果的影响,分别对rAAV2和rAAV8进行10分钟和20分钟热裂解处理并对定量数据进行比较,实验结果表明rAAV2和rAAV8两种病毒在10分钟和20分钟的条件下定量数据无显著差异(Fig8)。

Fig8、分别热裂解10分钟和20分钟对rAAV2和rAAV8病毒基因组拷贝数的定量数据
图中显示2和8分别代表rAAV2和rAAV8,其中圆点代表测得浓度,横线代表均值。
rAAV病毒样品 ITR与EGFP及WPRE的比值
ITR是位于rAAV病毒基因组两侧的短DNA 序列,当使用Msp I限制性内切酶切处理后,检测出的ITR拷贝数和EGFP(GOI)及WPRE基因的比例应该是2:1:1。在10分钟和20分钟热裂解处理后,分别检测rAAV2和rAAV8病毒样品的三个浓度梯度,计算ITR/EGFP和ITR/WPRE的比值并进行Bland-Altman一致性分析,实验数据表明rAAV2病毒样品处理过程中采用热裂解10分钟得到的结果更接近于预期比值,对rAAV8病毒样品的热裂解时间20分钟比值优于10分钟的比值。两种病毒之间关键基因的比值差异推测可能是由于rAAV血清型差异导致的。
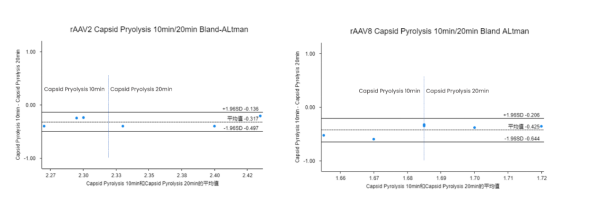
Fig9、Bland-Altamn分析不同热裂解时间对rAAV2和rAAV8中ITR、EGFP和WPRE定量比率的一致性
最后对两种病毒样品分别进行十倍梯度稀释检测(5个数据点,每个数据点重复3次)以验证cdPCR方法的灵敏度,同时可帮助评估LOQ定量检测限,结果如下表9所示,两种rAAV病毒样品的三个靶基因定量检测线性R2均接近1,对于低丰度样品三个靶基因均有检出。此外对低丰度样品判定,可以借助Crystal Miner软件的“Explore Crystal”功能对微滴进行追溯分析,确保结果真实可靠(Fig10)。
表9:rAAV2和rAAV8梯度稀释检测
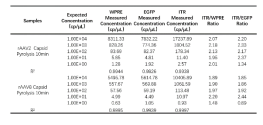
Fig10、Crystal Miner软件进行低丰度病毒样品中阳性微滴进行追溯分析
【总结】
cdPCR 进行rAAV病毒基因组拷贝数的定量检测具有更好的数据重复性和数据一致性,这一点对于rAAV基因组拷贝数定量以及成品的质量控制是至关重要的。此外cdPCR系统具备智能可视化Crystal Miner分析软件,可以进行数据的质控溯源分析,确保数据的精确性。本次实验数据基于三荧光通道cdPCR系统首次在同一反应中检测三个rAAV病毒样品中相关靶基因,对于三重数字PCR实验中各荧光通道之间的串扰现象,能够通过Crystal Miner分析软件手动或者自动实现荧光串扰的补偿校正,避免因荧光染料发射光谱之间叠加所造成的误差导致结果的误判(Fig13)。
Fig13、Crystal Miner软件进行荧光补偿校正
A、荧光补偿校正前,Blue通道和Green通道荧光图谱;B、荧光补偿校正调整前,Blue通道1D图;C、荧光补偿校正后,Blue通道和Green通道荧光图谱;D、荧光补偿校正后,Blue通道1D图。在B和D中灰色代表阴性微滴群体,蓝色代表阳性微滴群体。
最后我们探索出适合rAAV2和rAAV8病毒基因组拷贝数的定量检测流程(Fig14),本次实验旨在为基因治疗领域的科学家和研究学者提供一个参考依据,用于制定高效的rAAV病毒基因组拷贝数定量检测的解决方案。
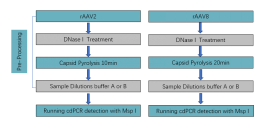
Fig14、rAAV2和rAAV8病毒基因组拷贝数的定量检测流程
【参考文献】
[1] Jude R , Samulski, Nicholas, et al. AAV-Mediated Gene Therapy for Research and Therapeutic Purposes.[J]. Annual review of virology, 2014.
[2] Keeler A M , Flotte T R . Recombinant Adeno-Associated Virus Gene Therapy in Light of Luxturna (and Zolgensma and Glybera): Where Are We, and How Did We Get Here?[J]. Annual Review of Virology, 2019, 6(1).
[3] Matthew R. PenningtonA et al. Platform Approach for Analytical Methods to Support Adeno-Associated Virus (AAV) Gene Therapy Products.[J]Charles river.
[4] Takashi Okada.Efficient AAV Vector Production System: Towards Gene Therapy For Duchenne Muscular Dystrophy.Intech.
【关于熙宁】
熙宁生物是一家专业的符合国际GLP&GCP质量管理规范的生物药生物分析实验室,为国内外生物医药公司提供临床和临床前大分子生物分析(Bioanalysis,BA) 和伴随诊断(Companion Diagnostics,CDx) 产品开发服务。
一站式的生物分析服务包括抗体制备和细胞株构建,样本采集包及实验室手册,符合法规要求的分析方法学的开发和验证,以及样本分析。检测类型涵盖药代动力学(PK),药效学(PD),抗药抗体(ADA),中和抗体(NAb),和生物标志物(Biomarker)检测,包括基于流式细胞术(FACS)和基因检测平台(PCR)针对细胞和基因治疗药物的PK, PD分析服务,以及细胞和基因水平的生物标志物检测、二代测序(NGS)服务。伴随诊断产品开发服务包括LDT方法学开发、CDx产品开发及验证、注册检验、临床试验研究和注册申报。
【关于艾普拜】
艾普拜生物科技(苏州)有限公司位于江苏医疗器械科技产业园,已通过国家高新技术企业,拥有2500平米的生产厂房。艾普拜生物作为临床分子检测的一体化解决方案供应商,致力于精准医疗诊断产品(诊断试剂、仪器)的研发、生产、销售和服务。公司基于先进的Naica CN数字PCR平台和自主专利的检测技术,持续开发以游离DNA作为检测材料的用于疾病诊断和治疗的基因检测项目和试剂盒,主要应用于与疾病相关分子及细胞遗传学检验、靶向用药指导的分子诊断检测等数十种临床检测产品,操作简便、结果迅速、分析简单,灵敏度高。
公司在检测仪器和试剂方面拥有多项核心技术,已获得国内外专利授权十余项,软件著作权多项。公司通过ISO9001、ISO13485等认证,具有完备的质量管理体系,继公司数字PCR系统于2021年3月获得医疗器械注册证后,实时荧光PCR分析仪同时获批医疗器械注册证。