



1.PROTAC概念介绍
PROTAC (Proteolysis Targeting Chimeras,蛋白降解靶向联合体) 是一种利用泛素-蛋白酶体系统(Ubiquitin-Proteasome System, UPS)对靶蛋白进行降解的药物开发技术(图1A)。PROTAC是一种异双功能分子,由结合靶蛋白(Protein of Interest,POI)的配体通过“Linker”连接到E3泛素连接酶的配体组成。该分子促进靶蛋白、PROTAC和E3连接酶的三元复合物形成,并使靶蛋白泛素化,随后,泛素化的POI被真核细胞中的内源性26s蛋白酶体识别和降解。例如,PROTAC分子ARV-825是由结合POI的配体、招募 E3 连接酶的配体和连接两个区域的Linker制成的异双功能降解剂,可以靶向降解BRD4(图1B)。
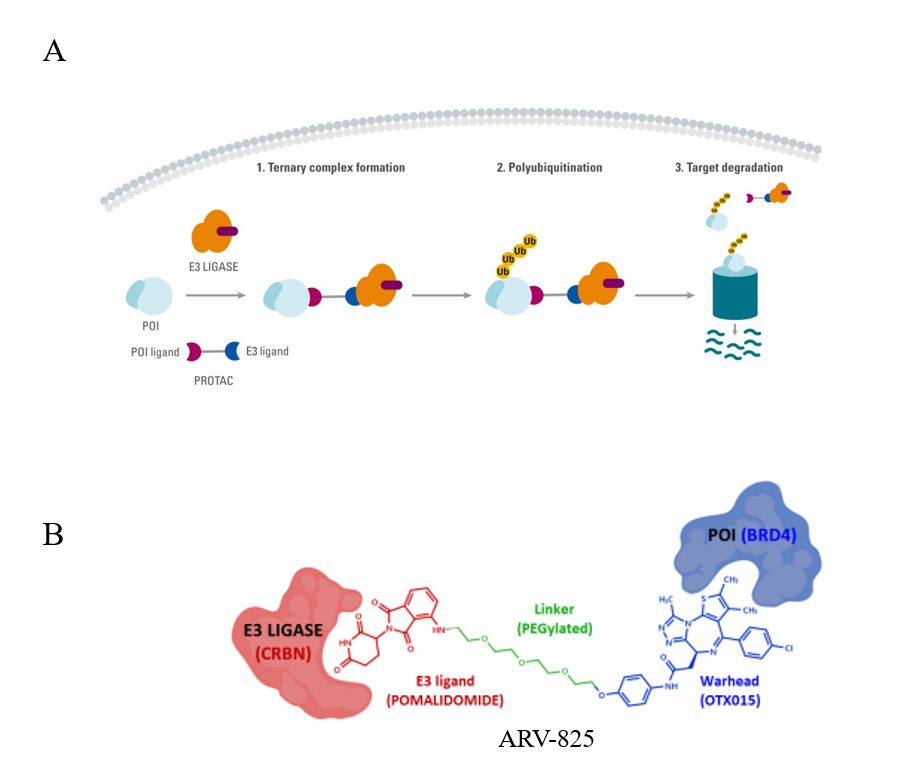
图1:A. PROTAC降解靶蛋白示意图;B. 降解剂ARV-825的结构及其作用机制
2.PROTAC研发现状
2001年,Crews小组报导了第一个PROTAC分子。近20年来,特别是2015年以来,PROTAC 领域进入了快速发展期。迄今为止,已经公开了多种基于不同 E3 连接酶和蛋白质配体的 PROTAC降解剂,可以降解不同类型的靶蛋白。6月9日,清华大学药学院饶燏团队在Signal Transduction and Targeted Therapy 杂志上发表了一篇综述论文,其中提到,2020-2021年新增了约90个可被PROTAC降解的蛋白质靶标,这远超此前18年的总量(40多个),这表明——蛋白质降解时代已经到来。
由于其独特的作用机制,PROTAC已被开发用于癌症、免疫相关疾病、病毒感染、神经退行性疾病等疾病的治疗,多款项目已经进入临床开发阶段。截止2022年3月,全球约有十几个PROTAC进入临床开发阶段,处于临床前的项目还有110个左右。目前,PROTAC 药物在全球暂无相关产品获批,进展最快的四个国际大型药企为Arvinas、Kymera、C4 Therapeutics(简称“C4T”)、Nurix。其中,Arvinas公司的ARV-110、ARV-471已进入临床Ⅱ期。同时,一些国内新药公司管线也有产品推进到临床Ⅰ/Ⅱ期,出现在国际最前沿,包括百济神州、开拓药业、海创药业、海思科、珃诺生物等。
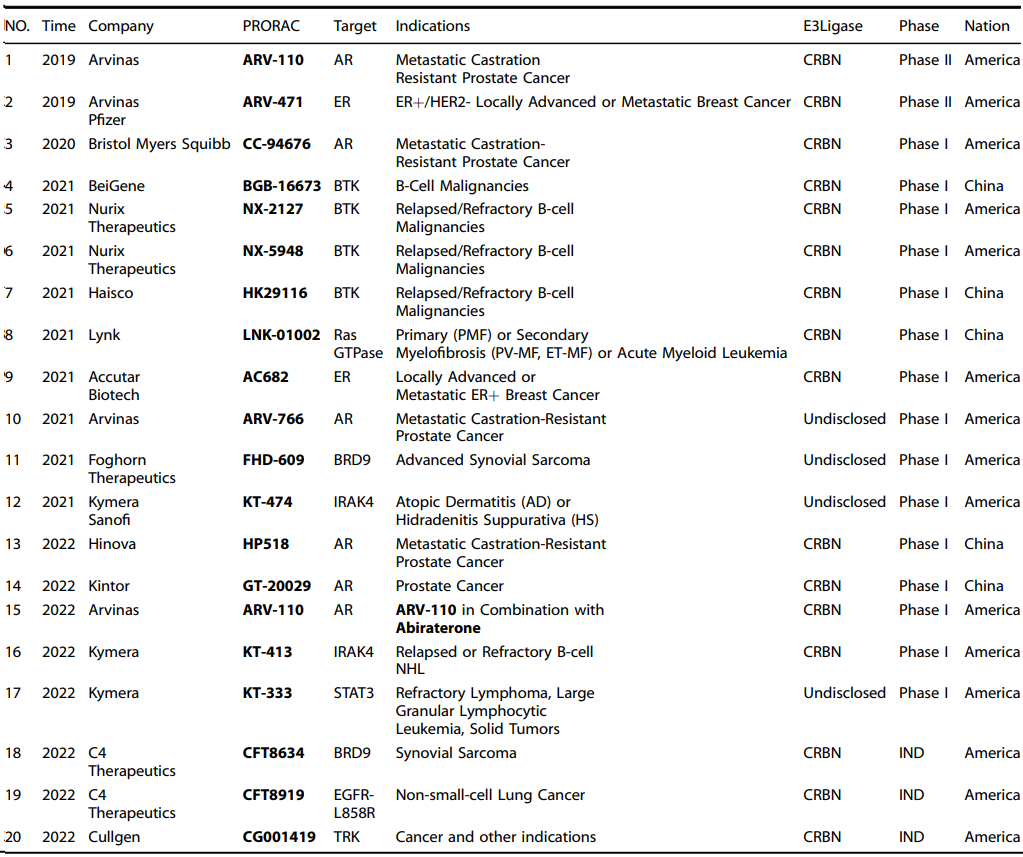
表1:全球临床和IND阶段基于PROTAC技术的蛋白质降解候选药物
3.PROTAC的优势
(1)不依赖“占位驱动”
从作用模式(Mode of Action,MOA)来看,传统的小分子和抗体药物都是需要抑制剂或单抗具备较高的浓度来占据靶点的活性位点,从而阻断下游信号通路的转导来发挥治疗疾病的作用,这种作用模式称为“占位驱动”。而PROTAC是“事件驱动”,只要产生结合作用就可以诱导相关靶蛋白的降解。
(2)可靶向“不可成药”靶点
大多数小分子药物或单抗需要结合酶或受体的活性位点来发挥作用,然而,据估计,人类细胞中80%的蛋白缺乏这样的位点。相比之下,PROTAC可以结合于靶蛋白表面的任何结合位点,更容易开发简单有效和选择性高的配体,作用于一些传统意义上不可成药的靶点。通过PROTAC技术靶向这些“不可成药”靶点蛋白可能会使靶点从“不可成药性”变成“可成药性”,将在疾病治疗中带来前所未有的突破。
(3)提高选择性
与传统小分子抑制剂相比,利用小分子抑制剂设计开发的PROTAC在某些靶点上可实现更好的选择性。当非选择性抑制剂作为POI 配体合成PROTAC时,不仅POI配体可以识别相应的目标蛋白,而且可以诱导 POI 和 E3 连接酶之间特定的蛋白质-蛋白质相互作用形成三元复合物。PROTAC分子对靶点蛋白的选择性可以理解为:一旦PROTAC和E3连接酶复合体形成二元复合体,对目标蛋白的结合位点附近的立体结构、凹槽深度、Linker旋转自由度等有了更高的要求,从而减少了可靶向降解的目标蛋白。
(4)催化剂量、低频次
PROTAC分子降解靶蛋白后能被循环利用,因此催化剂量即可产生很好的药理活性。秦冲等人发现的靶向降解(bromodomain and extra-terminal)BET蛋白的QCA570在细胞抗增殖活性方面表现出了明显优于BET 抑制剂JQ1等抑制剂的能力,达到了皮摩尔级水平。此外,PROTAC引发靶蛋白降解后,能够从复合物中解离,并进入下一个催化循环。一旦先前存在的蛋白耗尽,PROTAC只需要降解重新合成的靶蛋白,而大多数蛋白质的再合成速度很慢。因此使用PROTAC可以延长药物作用时间,减少用药频次。
(5)延长作用时间
靶蛋白的降解是时间依赖性的,PROTAC可以在几分钟内将细胞内靶蛋白消耗到接近基础水平。即使在PROTAC完全清除后,细胞可能仍需要一段相当长的时间,才能将蛋白质库恢复生理信号的水平,从而大大延长作用时间。
(6)克服药物耐用性
尽管临床上应用了多种治疗方法,但小分子抑制剂或拮抗剂在临床用药过程中,不可避免的都会发生获得性耐药。此外,目前对靶标的探索的重点是它们的酶促功能,而忽略了它们的支架部分的功能。与其事件驱动的药理学一致,PROTAC对目标蛋白的催化去除和整体降解是由结合靶蛋白而不是功能破坏驱动,非常适合治疗许多临床相关的、靶向治疗诱导的耐药机制。 这包括 1) 药物结合点突变而受损;2) 突变导致靶点组成激活;3) 突变诱导结合域构象变化;4) 通过靶点复合物重排获得支架功能;5) 靶蛋白过表达;;6) 竞争加剧来自内源性配体;7) 剪接突变。 PROTAC 可以基于中性结合剂构建,该结合剂可以结合靶蛋白的任何位置,这为解决突变变异开辟了新的机会。因此,在突变导致现有配体的结合亲和力完全丧失或结合位点丧失的情况下,可能会被用于开发新的 PROTAC结合剂。
4.PROTAC靶点选择与设计
目前文献报导的PROTAC可靶向降解不同类型的蛋白质,包括核受体(ER 和 AR等)、激酶 (Akt、BCR-ABL、c-ABL、BTK等)、转录因子 (Sirt2、HDAC6、TRIM24)、BET 溴结构域(BET蛋白)等。选择合适的目标蛋白配体,是PROTAC分子可以降解靶蛋白的关键,主要包括天然产物、酶抑制剂以及多肽。Linker其实没有一个特定的设计规律,主要有PEG,烷基,炔基,三唑环,哌嗪和哌啶等等,像ARV-110和ARV-471都是结合了哌嗪和哌啶设计的。人类基因组可以编码600多个E3泛素连接酶,目前在PROTAC设计中仅使用了少数E3连接酶,包括Von Hippel-Lindau(VHL)、cereblon(CRBN)、the mouse double minute 2 homologue (MDM2)等。效果较好、使用频次最高的E3连接酶主要是CRBN和VHL两种。其中,CRBN的配体主要是来那度胺、泊马度胺及其类似物,VHL的配体主要是VHL-L,各部分分类如图2所示。
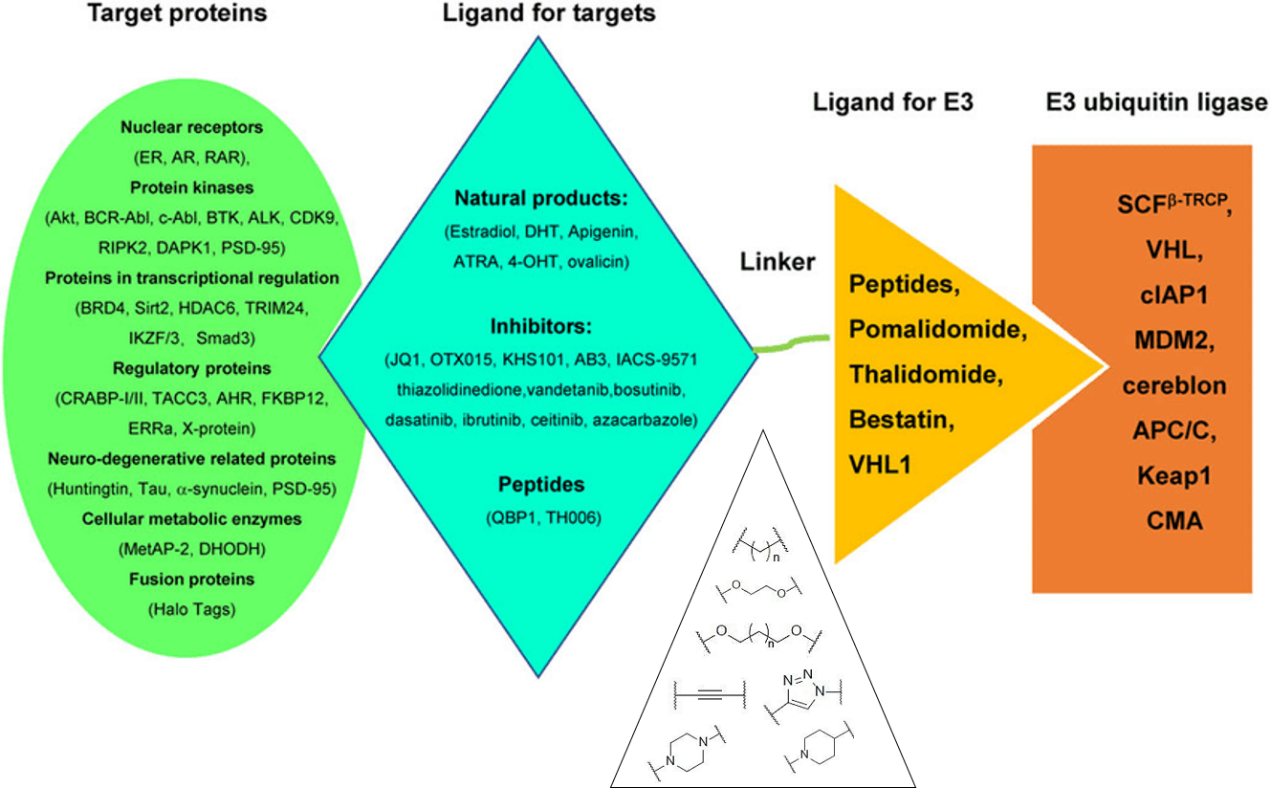
图2:PROTAC靶点、配体、连接子、E3泛素连接酶类别
5.PROTAC的药物代谢和药代动力学(DMPK)挑战
尽管PROTAC 具有良好的药效潜力,但是其双功能性质可能会导致物理化学特性,与传统小分子药物相比,专注于开发口服生物利用度降解剂的药物将面临复杂的药物代谢和药代动力学(DMPK)挑战。它们的主要物理化学特征通常包括高分子量(700 ~ 1200 Da)、高极性表面积、大量可旋转键以及较差的溶解性和渗透性。
(1)监管机构(美国FDA或ICH)没有针对特定DMPK挑战的具体指导。实际上,小分子药物的指导通常是根据具体情况提及的,但PROTAC与传统的小分子有显着不同。
(2)PROTAC的独特结构使得很难符合Lipinski为小分子设计的五个规则。这些药物的分子量通常落在700~1000 Da范围内,溶解度差。但符合Lipinski的亲脂性,氢键供体或受体和极地表面积的其他规则。
(3)PROTAC药物的渗透性较差,导致口服药物的药物能力差,并且体外和体内渗透性之间的相关性较弱。同样,小分子的体外通透性评估系统通常不适合PROTAC。
(4)PROTAC药物已显示出“hook” 效应(即,PROTAC在较大浓度的时候优先形成的是POI-PROTAC和E3-PROTAC两种二元复合物,影响三元复合物的形成,从而降低了疗效或有毒反应)。这要求药物研究界更清楚地了解PROTAC药物的PK/PD特征和适当的剂量范围。
(5)PROTAC的代谢产物,尤其是“linker”切割代谢物,可能会竞争结合靶标或E3连接酶。与“hook” 效应相似,这种结合可降低功效。因此,代谢物的分析和鉴定是其临床前筛查的关键部分,这不仅对于选择适当的毒理学物种,而且对于理解剂量反应关系而言至关重要。
最近,Dr. Liping Ma提出了七个提高PROTACs口服生物利用度的策略:1)与食物一起服用;2)通过更改linker长度,更改链接器的锚点,使用循环链接器以及更改接头的附件站点,以提高代谢稳定性PROTAC分子的代谢稳定性;3)优化linker 结构改善细胞渗透性;4)选择更小的E3连接酶配体;5)在PROTAC结构设计中引入分子内氢键从而降低分子大小和极性来促进细胞的渗透性;6)通过修饰药理学活性化合物获得前药;7)使用其他蛋白降解剂比如分子胶代替PROTAC。
6.PROTAC生物分析
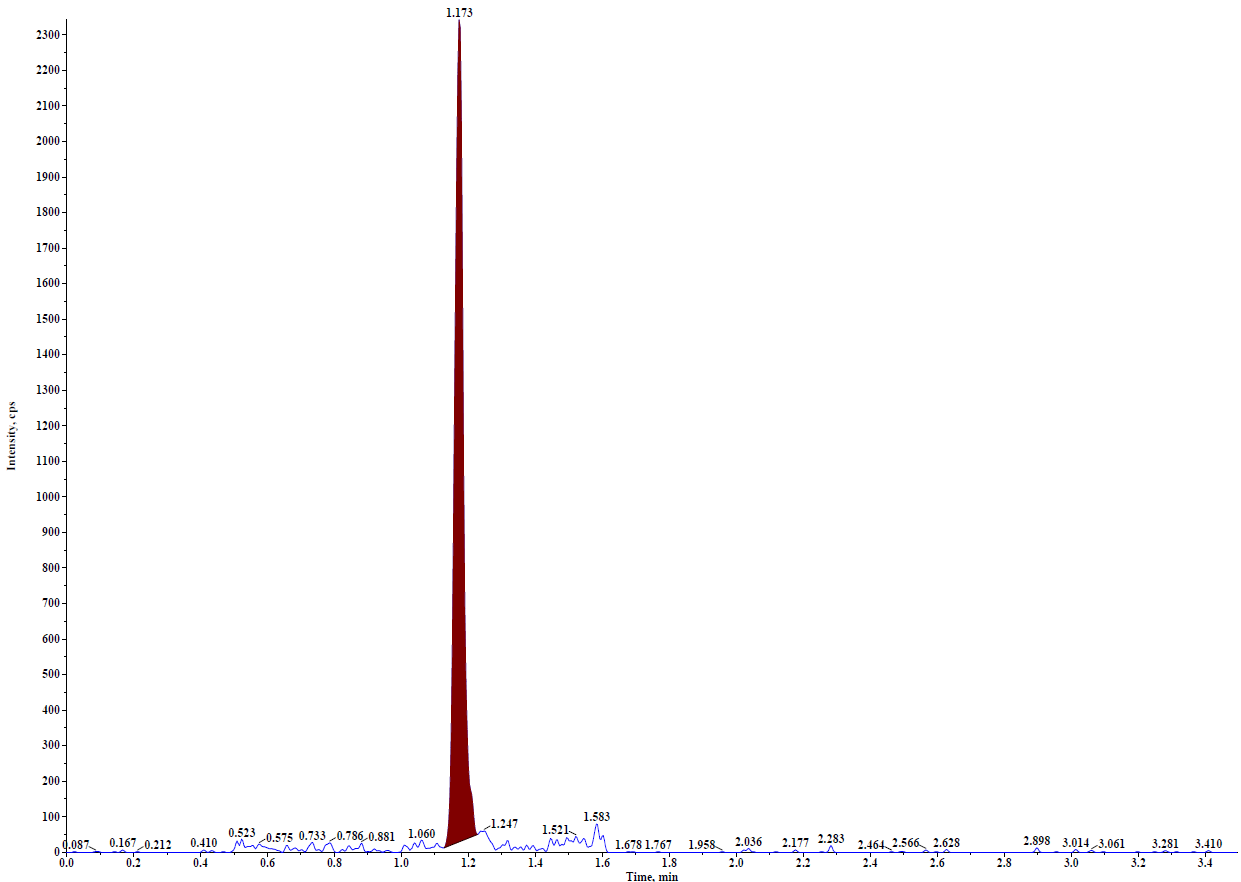
由于PROTAC分子结构和作用的机理,在生物分析中需要中需重点考察稳定性。可通过向样品中加入酶抑制剂或者低温处理样品来提高稳定性。此外在方法开发中发现,可能由于其亲脂性,有些PROTAC药物存在一定的非特异性吸附,因此在PROTAC生物分析中需要关注该问题。如图3所示,PROTAC药物定量下限为1.00 ng/mL,通过蛋白沉淀进行样品前处,从结果看,不管是干扰、灵敏度以及线性关系都是完全能满足临床样品的检测需求。此外本实验还进行了稳定性考察,如表2所示,不进行任何干预的情况下在实验台放置12小时样品降解超过20.0%,进行一定的干预措施后样品能够在实验台维持至少10个小时,因此该条件能完全保证样品采集和前处理过程中样品的稳定性。
A
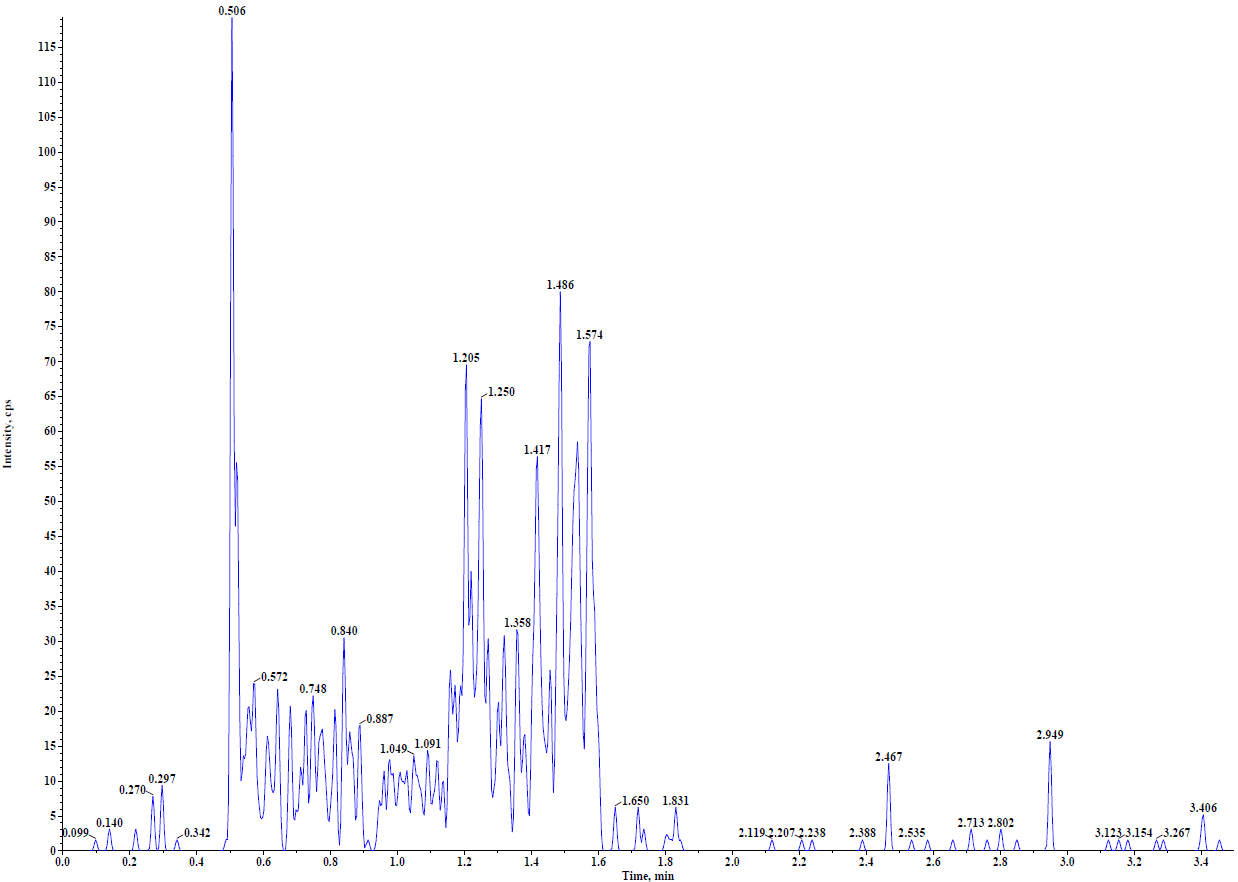
B
C
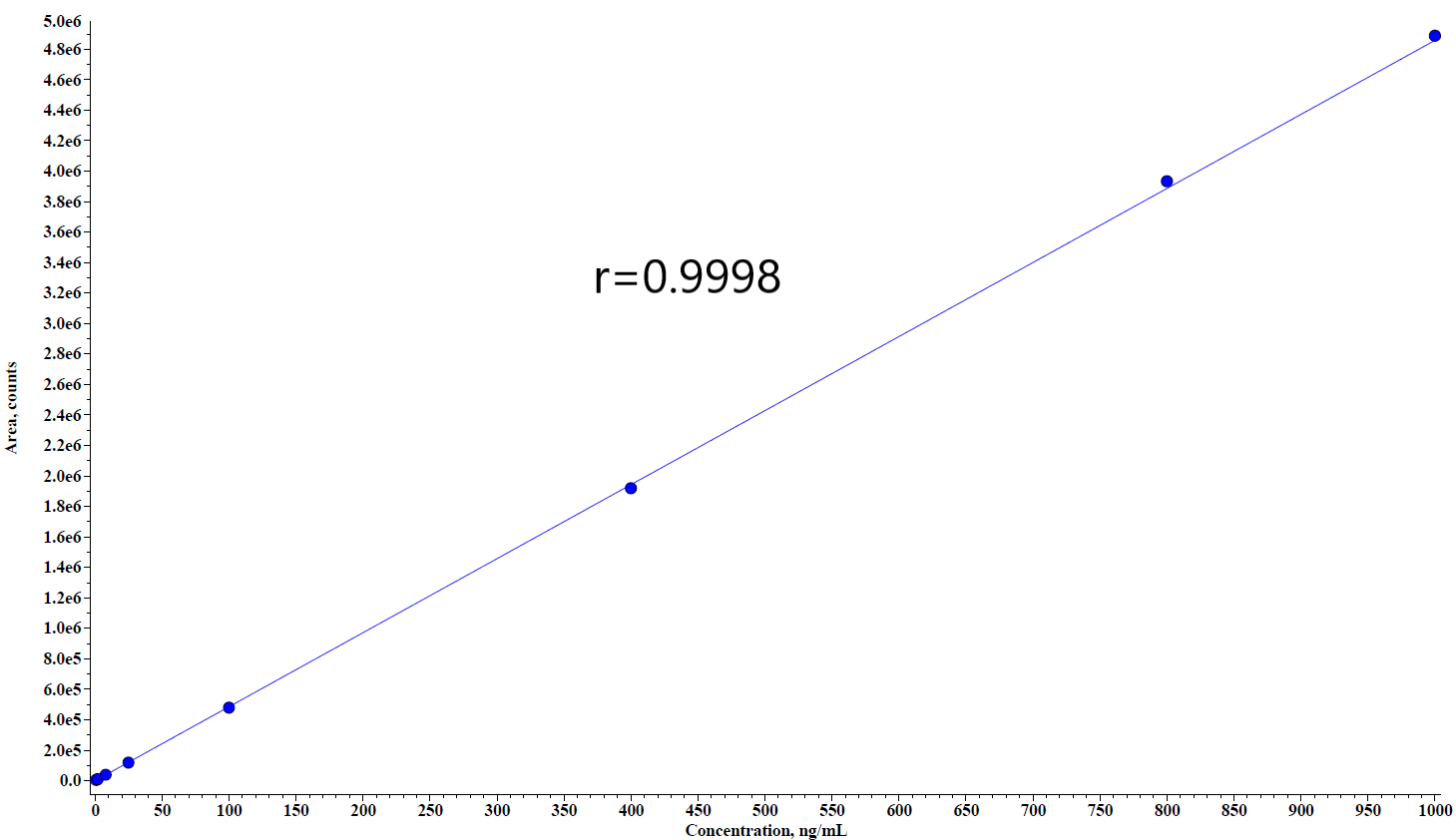
图3:A. 空白样品图谱;B. 定量下限图谱;C. 标准曲线图
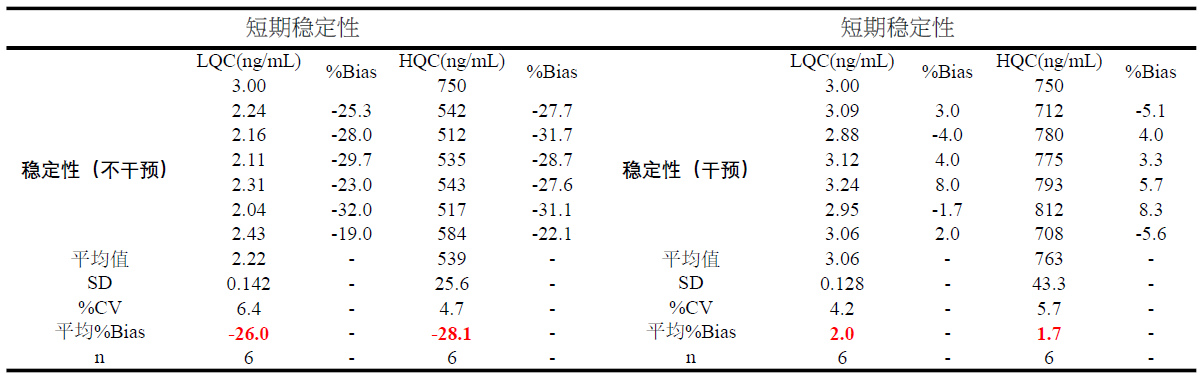
表2:短期稳定性数据表
7.结束
熙宁生物质谱平台能够提供符合NMPA/FDA/OECD/EMA的各项生物样品分析服务,支持小分子药物、多肽、寡核苷酸、PROTAC、ADC以及大分子抗体等药物的方法开发、验证和样品检测。平台配备了多套高端液质联用系统和Watson LIMS在内的生物分析系统和软件系统,各种先进辅助设备,不仅可以满足各型实验的检测需求,还大大提高实验效率和质量。 我们能够更快、更好的为客户提供专业的技术服务,更高效地帮助客户完成药品研发。
[1] Jimenez DG, Sebastiano MR, Caron G, Ermondi G. Are we ready to design oral PROTACs®? ADMET DMPK. 2021 Aug 31;9(4):243-254. doi: 10.5599/admet.1037. PMID: 35300370; PMCID: PMC8920102.
[2] He M, Cao C, Ni Z, Liu Y, Song P, Hao S, He Y, Sun X, Rao Y. PROTACs: great opportunities for academia and industry (an update from 2020 to 2021). Signal Transduct Target Ther. 2022 Jun 9;7(1):181. doi: 10.1038/s41392-022-00999-9. PMID: 35680848; PMCID: PMC9178337.
[3] Qin C, Hu Y, Bing Z, et al. Discovery of QCA570 as an Exceptionally Potent and Efficacious Proteolysis Targeting Chimera (PROTAC) Degrader of the Bromodomain and Extra-Terminal (BET) Proteins Capable of Inducing Complete and Durable Tumor Regression[J]. Journal of Medicinal Chemistry, 2018:acs.jmedchem.8b00506-.
[4] Zou Y, Ma D, Wang Y. The PROTAC technology in drug development. Cell Biochem Funct. 2019 Jan;37(1):21-30. doi: 10.1002/cbf.3369. Epub 2019 Jan 2. PMID: 30604499; PMCID: PMC6590639.
[5] Cantrill C, Chaturvedi P, Rynn C, Petrig Schaffland J, Walter I, Wittwer MB. Fundamental aspects of DMPK optimization of targeted protein degraders. Drug Discov Today. 2020 Jun;25(6):969-982. doi: 10.1016/j.drudis.2020.03.012. Epub 2020 Apr 13. PMID: 32298797.
[6] Pike A, Williamson B, Harlfinger S, Martin S, McGinnity DF. Optimising proteolysis-targeting chimeras (PROTACs) for oral drug delivery: a drug metabolism and pharmacokinetics perspective. Drug Discov Today. 2020 Oct;25(10):1793-1800. doi: 10.1016/j.drudis.2020.07.013. Epub 2020 Jul 18. PMID: 32693163.
[7] Sun X, Gao H, Yang Y, He M, Wu Y, Song Y, Tong Y, Rao Y. PROTACs: great opportunities for academia and industry. Signal Transduct Target Ther. 2019 Dec 24;4:64. doi: 10.1038/s41392-019-0101-6. PMID: 31885879; PMCID: PMC6927964.
[8] Nguyen TT, Kim JW, Choi HI, Maeng HJ, Koo TS. Development of an LC-MS/MS Method for ARV-110, a PROTAC Molecule, and Applications to Pharmacokinetic Studies. Molecules. 2022 Mar 18;27(6):1977. doi: 10.3390/molecules27061977. PMID: 35335338; PMCID: PMC8954769.