



1968年,法国病理学家 Jean Berger 首次报道了一种以 IgA 沉积为特征的肾小球疾病,命名为IgA肾病(IgAN),也称伯格病。该病是世界范围内最常见的原发性肾炎中占比高达25%-50%,是一种具有多种致病因素的顽固性疾病,也是导致慢性肾衰竭的重要病因。由于缺乏特异性治疗方法,约50%的IgAN患者会进展为终末期肾病[1]。
IgA肾病的诊断流程为:先通过尿常规、肾功能和血清学检测进行初步筛查,再借助病理、电镜等肾活检手段进一步确诊,同时需排除其他肾小球肾炎和肾脏综合症等疾病。另外,由于IgA肾病发病机制复杂,在诊断时还需综合了解患者的生活饮食习惯、肥胖、肠道感染、骨质疏松等情况,以便制定精准的诊断和后续个体化治疗方案[2]。
目前,IgA肾病的治疗手段主要包括基础治疗和免疫抑制治疗。基础治疗主要包括生活方式干预、控制血压、减少蛋白尿等支持性措施。免疫抑制治疗主要包括糖皮质激素、Gd-IgA1和免疫复合体调节、免疫抑制剂、新型补体调节剂以及传统中药的免疫调节等[3]。早期诊断和个体化治疗(尤其是控制蛋白尿和血压)对改善预后至关重要。未来研究方向包括探索精准免疫治疗、靶向异常 IgA1 生成及补体通路、靶向免疫异常和慢性肾病进展的IgAN综合治疗[9],以进一步提高疗效并降低副作用。
因此,合适的IgA肾病动物模型对于研究其病理过程和发病机制具有重要意义。当前常用的模型包括抗原免疫(BSA/LPS/CCL4、滴鼻仙台病毒等)诱导自身抗体产生的主动免疫模型,以及敲除或过表达关键基因(如 Myd88、Tgf-β1、hα1+/+CD89+/+、hBAFF等)的基因编辑模型。其中,BSA/LPS/CCL4诱导的IgA疾病模型是评估IgA肾病药物疗效和探索新疗法的常用代表性模型[4][5]。
PART 01
IgA肾病发病机制
IgA肾病的发病机制尚不明确,目前比较公认的是“四重打击”学说[6],如图1所示:打击1:遗传或环境因素导致Gd-IgA1 (半乳糖缺陷型IgA1) 产生[7],从粘膜或可能的全身来源进入循环,这种异常的抗体对于机体而言也是一种抗原物质;打击2:产生自身反应性IgG自身抗体,识别IgA1的特异性O-糖型(抗Gd-IgA1 IgG),循环中针对Gd-IgA1的特异性抗体产生(大多为IgG, 少数为IgA1) ;打击3:自身抗原(异常糖基化的IgA )和自身抗体在循环中形成Gd-IgA1致病免疫复合物;打击4:致病性免疫复合物穿过肾小球内皮细胞,沉积于肾小球系膜中,引发炎症级联反应,导致系膜细胞增殖,激活替代和凝集素补体途径,募集单核/巨噬细胞募集和循环中的T细胞,进而造成肾小球损伤[8]。
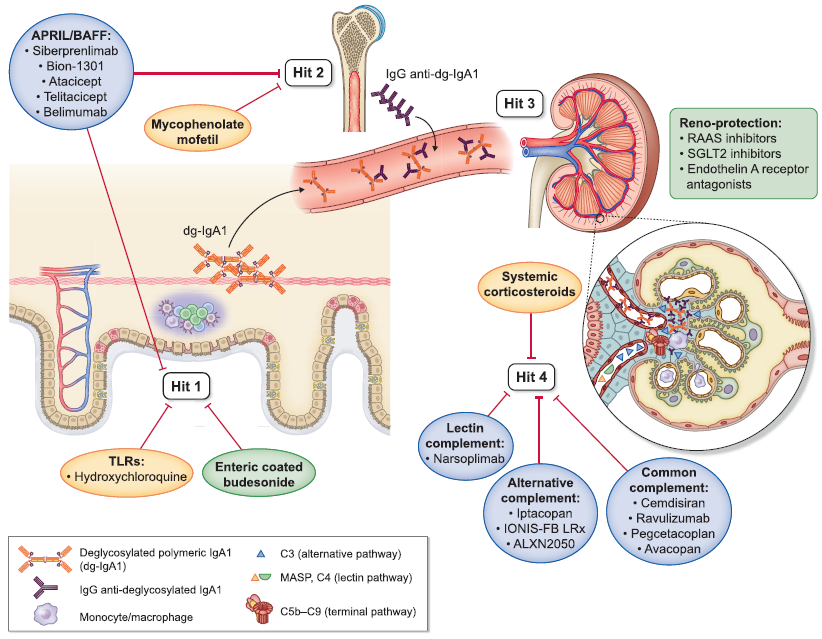
图 1 IgA肾病发病机制 “四重打击” 学说示意图
PART 02
BSA/LPS/CCL4诱导的IgA肾病模型
长期口服或者注射牛血清蛋白(BSA)可诱导机体产生异常的免疫应答,导致 IgA 抗体生成增加并沉积于肾小球系膜区,形成免疫复合物,激活补体系统(如 C3),引发系膜细胞增生和炎症反应。脂多糖(LPS)作为内毒素,可诱导单核/巨噬细胞释放促炎细胞因子(如 IL-6、TNF-α),促进 B 细胞增殖和 IgA 分泌,增强免疫原性。同时LPS 可通过损伤血管内皮细胞,增加肾小球通透性,破坏肾小球滤过屏障,促进免疫复合物(如 BSA-IgA)在系膜区沉积。CCL4则通过激活肝星状细胞和炎症反应造成造成肝损伤,影响 IgA 的清除,导致循环中 IgA 水平升高并沉积于肾小球。此外,CCL4引起的全身性炎症反应可间接促进B细胞活化和IgA分泌,加重肾脏免疫损伤[10]。
实验中选用8周龄的雄性Sprague-Dawley (SD) 大鼠,首先进行单侧肾切除手术,术后恢复一周进行BSA/LPS/CCL4诱导造模:BSA 400 mg/kg每隔一天灌胃一次;CCL4 (1:4溶解在橄榄油中)1.5 μL/g腹腔注射每周一次;LPS 0.5 mg/kg 腹腔注射每周一次;连续诱导造模10周。BSA/LPS/CCL4诱导4周后,根据体重、尿肌酐(CRE)和白蛋白(ALB)水平等指标将大鼠随机分组,然后进行药物干预,最终通过尿ALB水平和尿白蛋白肌酐比值(UACR)、肾脏IgA和C3染色等指标来评价药物的治疗效果[11]。

图2 模型构建方案
PART 03
关键数据

ALB和UACR变化
蛋白尿水平常作为临床研究的替代终点。2021年12月,FDA首次基于蛋白尿下降这一替代临床终点批准了IgA肾病新药TARPEYO(布地奈德)。如图3所示,模型组大鼠的尿ALB水平和UACR显著升高。待测化合物给药6周后,尿ALB水平和UACR显著性下降。
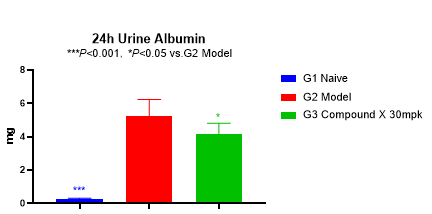
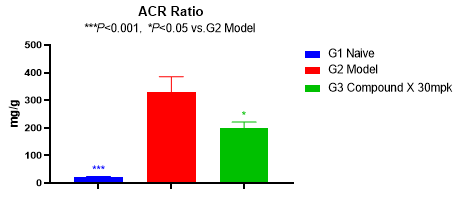
图3 ALB和UACR变化

IgA和C3 染色
如图4所示,模型组大鼠肾小球系膜区IgA和C3的沉积水平显著升高。药物处理6周后,IgA和C3沉积水平有明显的下降。
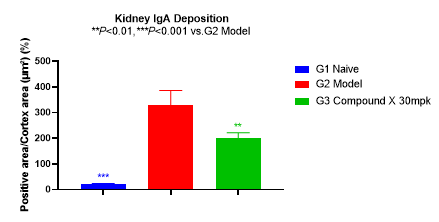
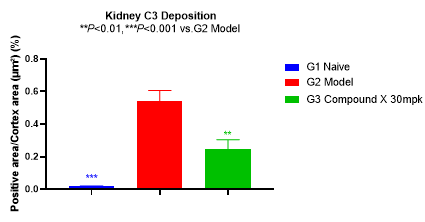
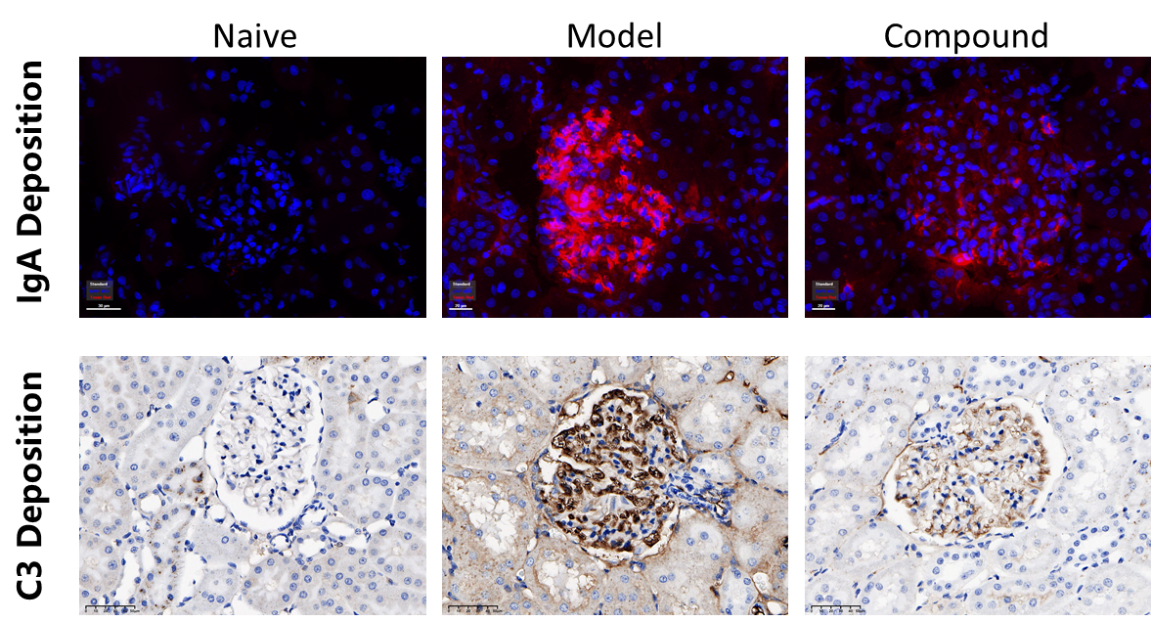
图4 IgA和C3染色和统计结果
本实验通过单侧肾切除术联合BSA/LPS/CCL4诱导,成功建立了大鼠IgA肾病动物模型。大鼠尿ALB水平和UACR值显著升高,肾小球IgA和C3沉积水平显著增加,部分模拟了临床患者的症状,符合患者的临床表现,与文献报道基本一致。药物处理6周后,尿ALB水平和UACR有明显的下降,肾小球 IgA和C3的沉积水平显著下降,表明该模型可用于评估药物对于IgA肾病的治疗效果。
在疾病模型领域,熙宁生物|精翰生物临床前药理部门已经建立了包含200+种模型的完善动物模型库,涵盖炎症和自身免疫疾病(如皮肤疾病、关节炎、多发性硬化、红斑狼疮、葡萄膜炎、肠炎等)、纤维化(如肺纤维化、肝纤维化、皮肤纤维化、肾纤维化)、肺部疾病(如肺纤维化、哮喘、急性肺损伤 )、代谢系统疾病(如非酒精性脂肪性肝炎(NASH)、肥胖、糖尿病肾病、肝纤维化)、肾脏疾病模型(如急性肾损伤、慢性肾损伤、肾纤维化、糖尿病肾病、IgA肾病)、疼痛(如炎性疼痛、神经性疼痛、偏头疼、术后疼痛、关节疼痛)、神经退行性疾病(如阿尔兹海默病(AD)、帕金森病(PD))等多个领域,可以为客户提供丰富的药物评价动物模型。在重点聚焦炎症和自身免疫疾病领域的同时,也可根据客户需求提供相应的定制化模型服务。
欢迎后台留言咨询。
参考文献:
[1] Naka S, Matsuoka D, Misaki T, et al. Contribution of collagen-binding protein Cnm of Streptococcus mutans to induced IgA nephropathy-like nephritis in rats. Commun Biol. 2024;7(1):1141.
[2] Floege J, Rauen T, Tang SCW. Current treatment of IgA nephropathy. Semin Immunopathol. 2021;43(5):717-728.
[3] Di Leo V, Annese F, Papadia F, et al. Refractory IgA Nephropathy: A Challenge for Future Nephrologists. Medicina (Kaunas). 2024;60(2):274.
[4] Suzuki H, Suzuki Y, Novak J, Tomino Y. Development of Animal Models of Human IgA Nephropathy. Drug Discov Today Dis Models. 2014;11:5-11.
[5] Kano T, Suzuki H, Makita Y, et al. Lessons from IgA Nephropathy Models. Int J Mol Sci. 2024;25(21):11484.
[6] Gleeson PJ, O'Shaughnessy MM, Barratt J. IgA nephropathy in adults-treatment standard. Nephrol Dial Transplant. 2023;38(11):2464-2473.
[7] Mestecky J, Novak J, Moldoveanu Z, Raska M. IgA nephropathy enigma. Clin Immunol. 2016;172:72-77.
[8] Nishie T, Miyaishi O, Azuma H, et al. Development of immunoglobulin A nephropathy- like disease in beta-1,4-galactosyltransferase-I-deficient mice. Am J Pathol. 2007;170(2):447-456.
[9] Floege J, Bernier-Jean A, Barratt J, Rovin B. Treatment of patients with IgA nephropathy: a call for a new paradigm. Kidney Int. 2025;107(4):640-651.
[10] Lu H, Chen LL, Jiang XY, Mo Y, Ling YH, Sun LZ. Temporal and spatial expression of podocyte-associated molecules are accompanied by proteinuria in IgA nephropathy rat model. Physiol Res. 2013;62(1):35-45.
[11] Guo N, Liu S, Bow LM, et al. The protective effect and mechanism of rapamycin in the rat model of IgA nephropathy. Ren Fail. 2019;41(1):334-339.