



系统性红斑狼疮(Systemic Lupus Erythematosus,SLE)是一种复杂的自身免疫性疾病,好发于育龄期女性。SLE 的病理特征在于自身免疫耐受的丧失导致多种自身抗体的形成,进而引发多种免疫复合物在体内沉积,引起多器官炎症,累及皮肤、肾脏、关节和神经系统等,其发病机制涉及遗传、免疫失调、环境因素等多方面的相互作用。
PART 01
SLE复杂的发病机制与精准医疗的必要性
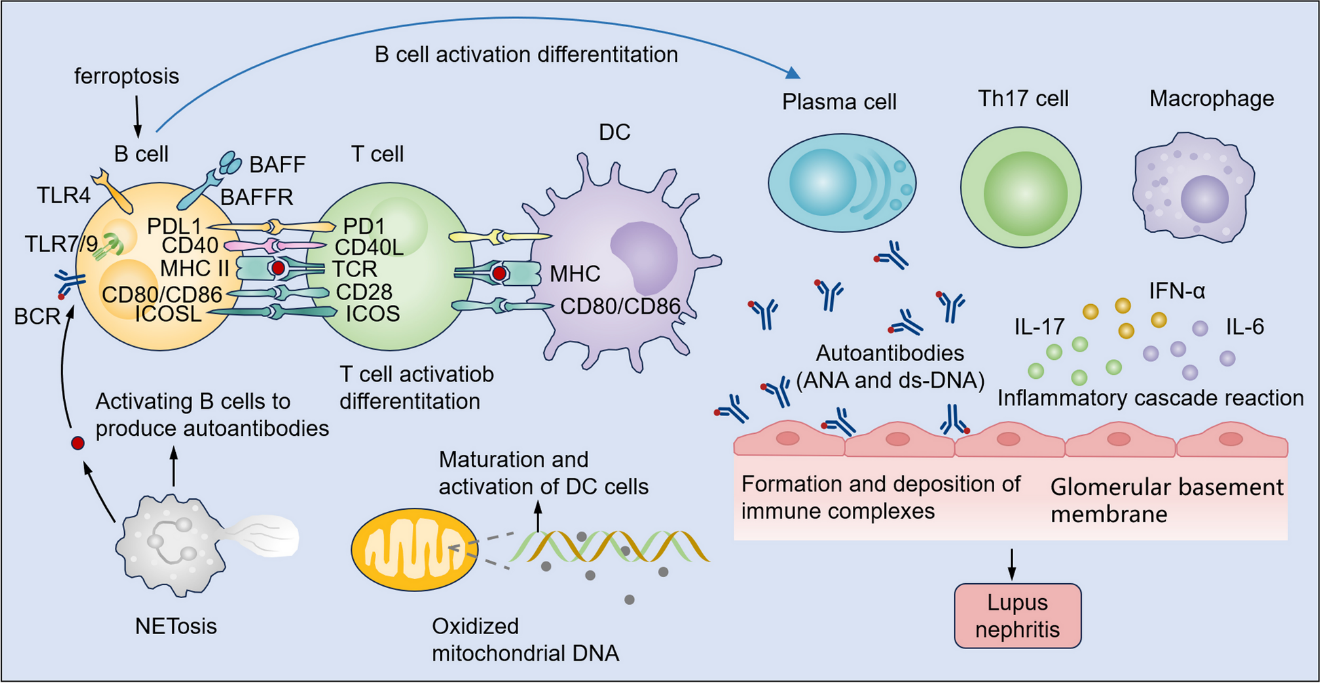
图1 免疫细胞异常的相互作用引起SLE的发生
以由SLE引发的狼疮性肾炎为例,SLE的发病机制涉及B细胞、T细胞、树突状细胞(DC)和其他免疫成分之间复杂的相互作用,主要包括:
(1) 异常B细胞过度产生自身抗体,导致免疫复合物形成并沉积在肾脏中,激活补体系统并引发炎症反应。
(2) 自身反应性B细胞向T细胞呈递自身抗原,使免疫失调永久化,并促进促炎介质的释放。
(3) 树突状细胞表现出对自身抗原的异常识别和呈递,从而引发和传播针对肾组织的自身免疫反应。
(4) B细胞分化为分泌自身抗体的浆细胞受到失调,导致肾源性自身抗体的持续产生。
传统的治疗策略,如使用糖皮质激素、免疫抑制剂和抗疟药等,虽然能够在一定程度上控制疾病活动,但往往缺乏针对性,难以实现个体化的精准治疗。此外,这些药物的副作用也限制了其长期使用的效果。因此,开发针对SLE患者特定免疫靶点的精准治疗药物,成为当前研究的重点方向。
PART 02
新一代测序技术助力SLE药物研发
近年来,随着精准医疗理念的兴起,基因组学、单细胞转录组测序、单细胞免疫组库测序、表观遗传学、代谢组学等多组学的发展及交叉学科的融合,推动了SLE发病机制的深入研究,也为SLE治疗提供了更多的靶向选择。生物制剂作为精准靶点药物,有利于尽快控制SLE疾病活动、激素助减及维持疾病缓解;细胞免疫治疗等新兴治疗方法为难治性狼疮提供了更多的治疗选择,也为SLE的药物研发带来了新的机遇和突破。

免疫组库分析与靶向治疗
B 细胞的异常激活被认为是SLE发病的标志,其主要致病特征包括:抗原呈递能力增强、浆母细胞及记忆细胞数量增加、炎性细胞因子分泌异常和致病性自身抗体过度产生。自身抗体和自身反应性B细胞在疾病进展和靶器官损伤中起着至关重要的作用。
目前为止,已有多种靶向B细胞的治疗方法,包括靶向B细胞表面蛋白、靶向B细胞存活和激活因子、阻断共刺激分子抑制T⁃B细胞相互作用、调节B细胞信号通路以及细胞免疫疗法等。
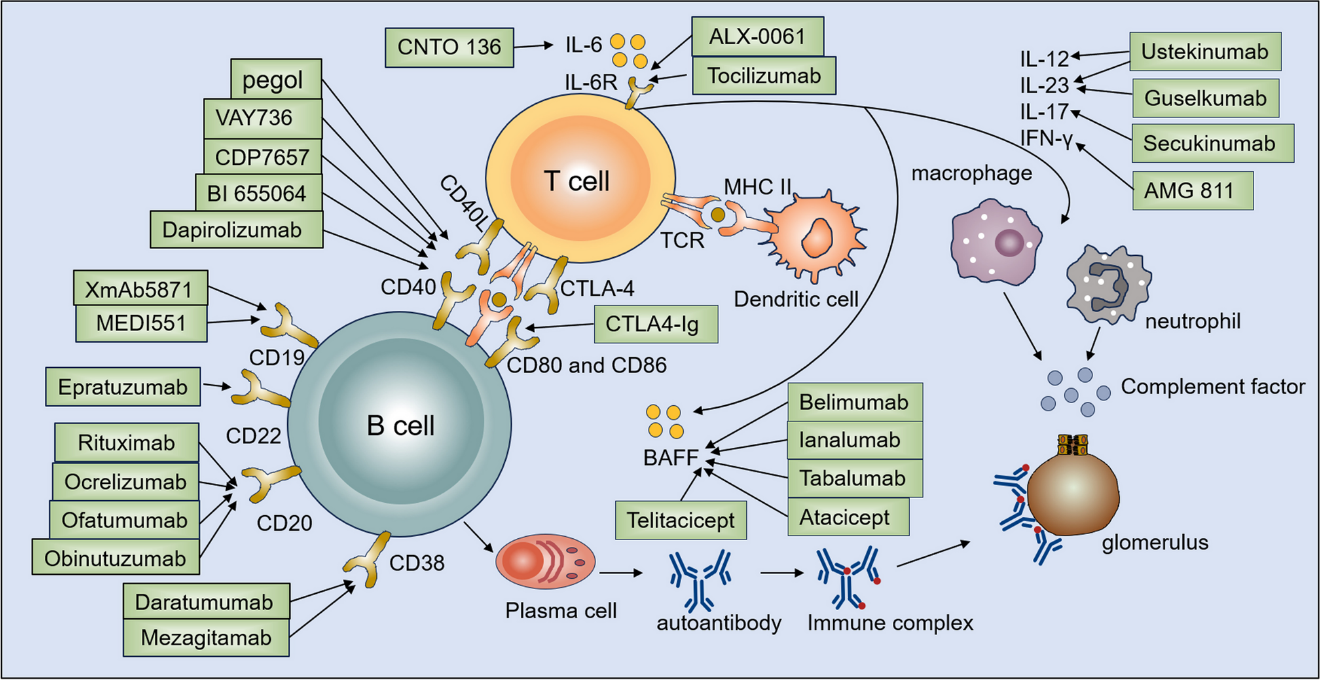
图2 靶向T细胞与B细胞的SLE治疗措施
针对B细胞的治疗策略包括针对B细胞表面受体(CD10、CD20、CD22、CD38、CD40)和针对B细胞相关细胞因子(BAFF);
针对T细胞的治疗策略包括共刺激阻断(CD40-CD40L、CD80/86-CD28、ICOS-ICOSL)和细胞因子阻断(IL-6、IL-12、IL-17、IL-23、IFN-γ)
SLE患者的免疫系统存在显著的失调,B细胞和T细胞的异常激活是疾病发生的关键因素之一。基于多重扩增的免疫组库测序技术或基于单细胞转录组测序的免疫组库测序技术,可以对患者的免疫组库进行全面分析,揭示B细胞和T细胞受体(BCR和TCR)的克隆性、多样性以及抗原特异性。通过这些分析,研究人员可以深入了解SLE患者免疫细胞的异常激活机制,同时监控针对特定免疫细胞亚群的靶向治疗药物的临床治疗效果。

mRNA测序检测INF-α的表达水平与免疫相关通路的激活程度
干扰素(interferon,IFN)是一种能够有效调控免疫系统活化、抗病毒感染及抑制肿瘤生长的细胞因子,主要由一些核酸物质激活细胞内的TLR(Toll 样受体),导致下游信号通路活化而产生。I型IFN可与其异源二聚体受体(interferon receptor,IFNAR)结合,介导抗病毒反应,在急性病毒感染初期达到峰值,在病毒清除后会恢复正常。然而,在SLE患者体内,IFN通路随着时间的推移而不断被激活,随后对SLE的先天性和适应性免疫反应产生调节作用。
浆细胞样树突状细胞(pDCs)是IFN-α的主要产生细胞。在SLE中,pDCs被激活后分泌大量IFN-α,进一步激活T细胞和B细胞;IFN-α能够促进B细胞的活化、增殖和分化,增强自身抗体的产生;IFN-α还可以通过上调B细胞表面的共刺激分子(如CD86),促进B细胞与T细胞的相互作用;IFN-α能够增强T细胞的活化,特别是辅助性T细胞(Th1、Th17)的分化,同时抑制调节性T细胞(Tregs)的功能,导致免疫失衡;IFN-α能够增强中性粒细胞的活性,促进其产生中性粒细胞外陷阱(NETs),这些NETs能够诱导自身免疫反应。
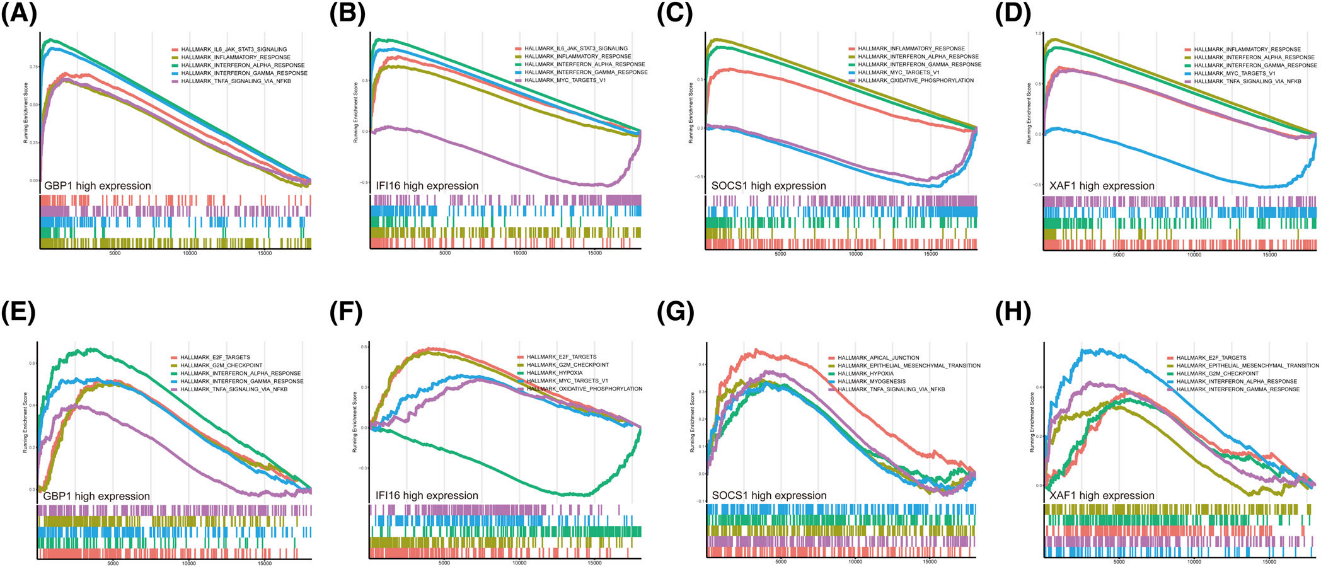
图3 系统性红斑狼疮中核心共享基因的基因集合富集分析结果
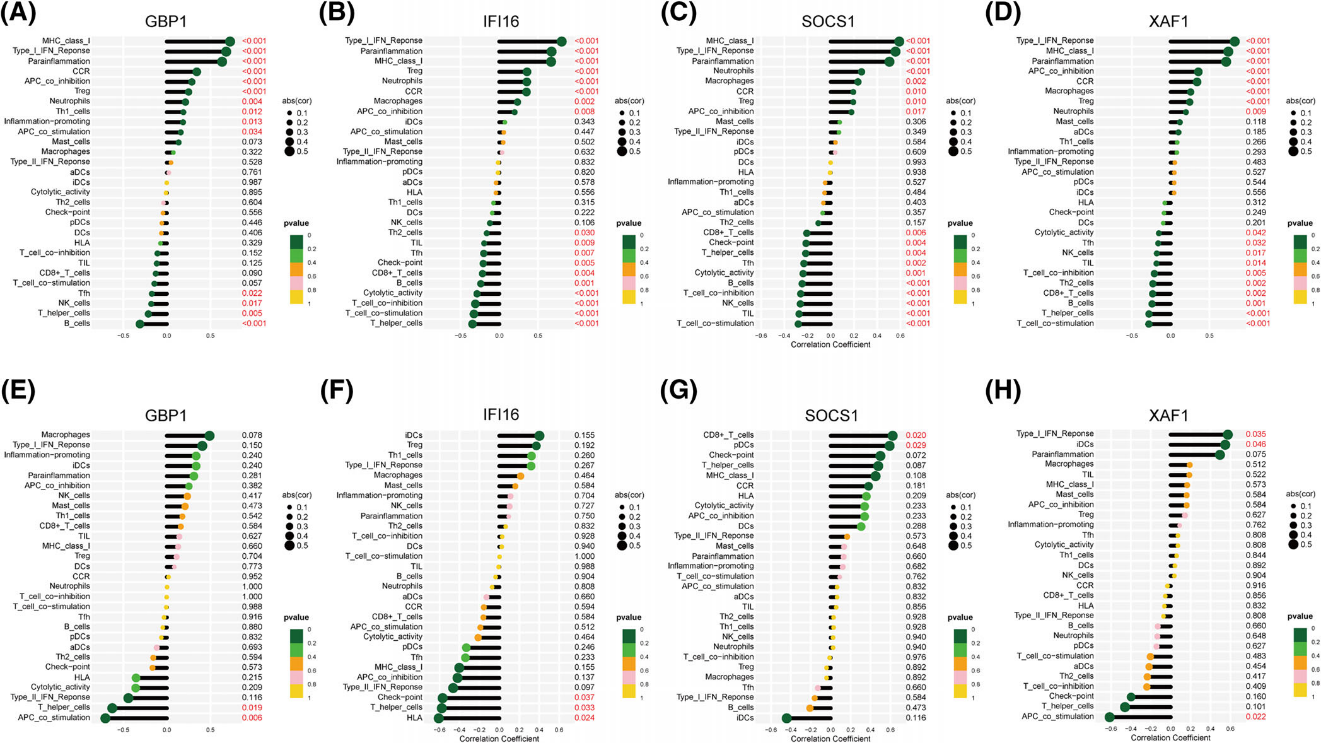
图4 系统性红斑狼疮核心共享基因的免疫浸润分析
SLE患者体内IFN-α的水平显著升高,这种升高不仅存在于外周血中,还涉及多种免疫细胞。转录组测序技术能够全面分析SLE患者外周血单核细胞中的mRNA表达谱,揭示IFN-α信号通路相关基因的异常表达。此外,SLE的发病机制涉及多种免疫细胞及免疫成分之间复杂的相互作用。通过转录组测序技术,对核心基因进行基因集富集分析与免疫浸润分析,提示有明显的免疫炎症反应,尤其是INF信号通路,为SLE的精准治疗提供新的靶标。
随着chatGPT与Deepseek等人工智能算法的成熟与普及与AlphaFold-3的兴起,高通量测序技术结合多组学技术(如蛋白质组学、代谢组学)和人工智能算法,有望进一步提高对SLE发病机制的理解和药物研发的效率。此外,精准医疗理念的推广也将促使更多基于二代测序技术的个性化治疗方案进入临床应用,通过深入分析SLE患者的遗传背景、免疫细胞特征和疾病进展过程中的分子变化,研究人员可以发现潜在的药物靶点,开发精准治疗药物,并制定个性化的治疗方案,为SLE患者带来更多的希望。
熙宁|精翰自主研发的转录组测序技术能够提供全面的基因表达分析,有助于深入理解不同实验条件下的基因表达水平的定量变化,差异基因的通路富集分析进一步反应由实验或药物作用而引起的机体生物学状态的变化;单细胞转录组测序技术能够对单个细胞进行高精度的基因表达定量分析,通过对细胞类型进行注释、细胞亚群差异基因分析、拟时序分析、基因集打分等,从细胞层面深入理解药物的作用机制;此外5’-转录组测序可以同时对样本的免疫组库进行检测,通过分析单个免疫细胞的BCR/TCR序列,可以鉴定T/B细胞的克隆型及其多样性,结合细胞类型解析细胞的异质性与T/B细胞的克隆扩增情况。这一技术不仅有助于发现新的免疫细胞亚群,还能揭示药物对免疫细胞功能的精细调控,为免疫治疗药物的研发提供有力支持。
参考文献:
[1] Su X, Yu H, Lei Q, et al. Systemic lupus erythematosus: pathogenesis and targeted therapy[J]. Molecular Biomedicine, 2024, 5(1): 54.
[2] Yuan X, Zheng Z, Lai W. Shared molecular signatures between systemic lupus erythematosus and osteoporosis[J]. Environmental Toxicology, 2024, 39(10): 4744-4753.