



特发性肺纤维化 (Idiopathic Pulmonary Fibrosis, IPF) 是一种慢性、进行性、纤维化性间质性肺炎,具有较高的发病率和死亡率。其主要特征包括持续的肺部炎症、肺泡表面功能和结构的破坏、间质成纤维细胞异常增殖和细胞外基质过度合成与沉积,导致持续的间质纤维化和气道僵硬。这些改变最终可进展为进行性呼吸衰竭并导致死亡。大多数IPF患者为男性,发病时年龄通常在60岁以上,确诊后生存期限制在3-5年。IPF的病因尚未完全确认,目前认为其发生和发展与多因素的发病机制与交叉遗传易感性、老化和环境因素相关。遗传因素大约只能解释20%的病例,而约75%的病例与吸烟史有关[1]。
现有传统治疗手段包括糖皮质激素、免疫抑制剂、有氧疗法、肺部康复训练和肺移植等。其中药物治疗和肺移植相对。肺移植对于严重IPF患者可能是一种有效的治疗方案,但受限于肺源、手术条件和费用。药物治疗疗效比较有限,目前只能在一定程度上延缓纤维化进程,难以完全逆转已形成的纤维化组织,同时还会引起较多的不良反应。近年来,干细胞用于IPF治疗的相关研究越来越多,包括肺源性干细胞、胎盘或骨髓来源的间充质干细胞、胚胎干细胞以及诱导多能干细胞等。干细胞定向分化可以促进肺组织再生和肺功能恢复,同时其旁分泌作用能够抑制炎症并发挥免疫调节作用,为IPF治疗带来新的希望[2][3][4]。
合适的动物模型对于研究IPF的病理过程和发病机制至关重要。目前常用的环境诱导因素有二氧化硅、博来霉素等,其中博来霉素诱导的小鼠模型是评估IPF药物疗效和探索新疗法比较常用的代表性模型[5]。
PART 01
发病机制
遗传因素(如端粒酶逆转录酶TERT、 黏蛋白5B MUC5B等)影响肺上皮细胞的完整性,环境因素(如吸烟、微生物)和衰老相关的变化会触发表观遗传重编程。这三种因素共同作用会引起上皮细胞损伤,触发上皮细胞异常活化。活化的上皮细胞分泌大量TGF-β等细胞因子,促进成纤维细胞迁移和增殖,也促进成纤维细胞向肌成纤维细胞分化。肌成纤维细胞分泌大量细胞外基质(ECM),导致ECM沉积。此外,上皮细胞损伤、干细胞功能障碍和衰竭、ECM异常沉积和基质僵硬在肺异常纤维化进展和肺结构重塑中起着至关重要的作用[1][6]。
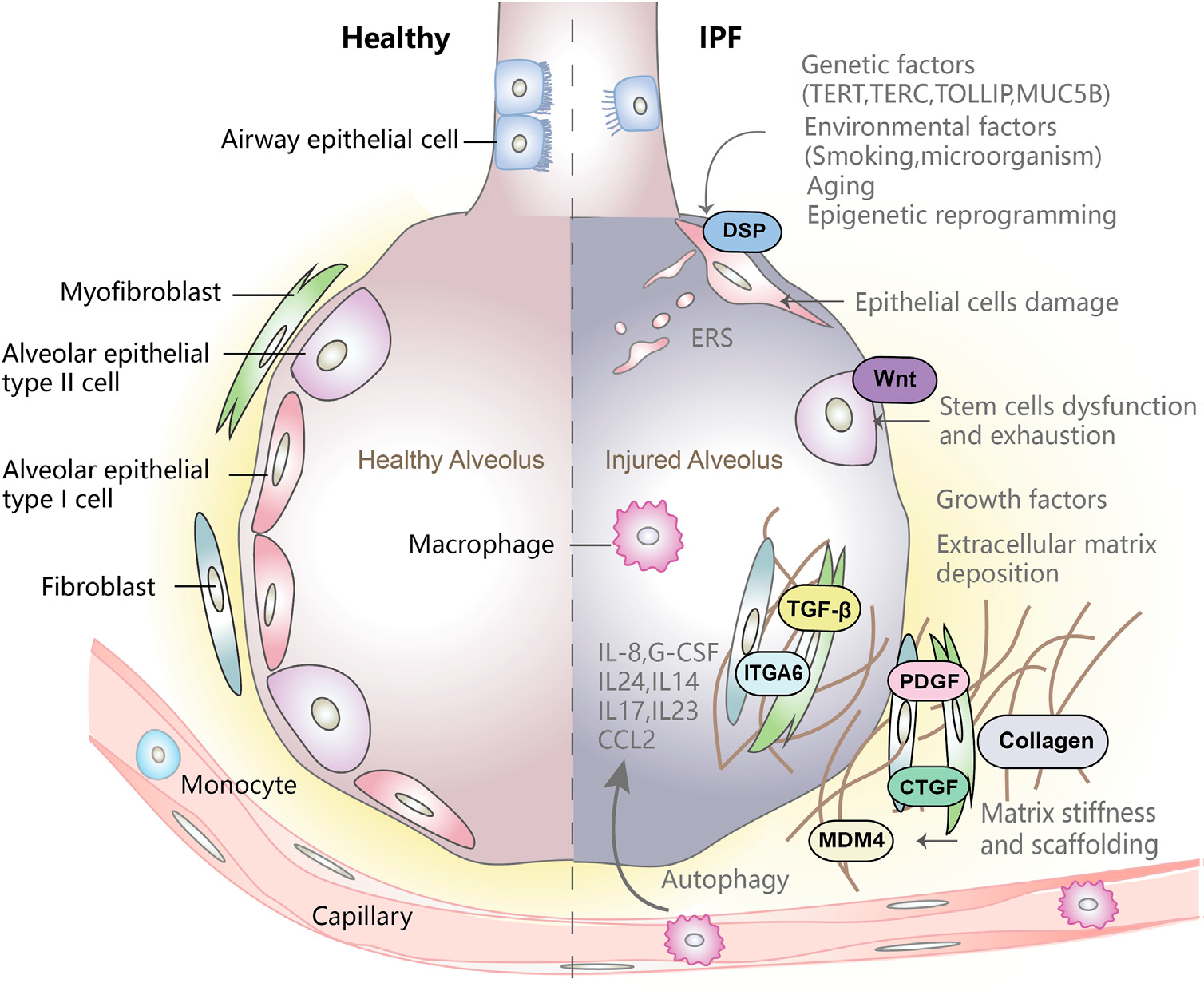
图1 IPF发病机制示意图[1]
PART 02
博来霉素诱导的小鼠肺纤维化模型
C57BL6对博来霉素的敏感性高于BALB/c小鼠,老年小鼠对博来霉素的纤维化反应更为明显。博来霉素通过肺部直接给药引起原发性肺泡上皮细胞损伤,可以模拟重复性或慢性损伤的病理过程,其特征为给药后 7天纤维化形成并在14-21天成熟[5]。
本研究采用8周龄的雄性C57BL6小鼠,按照1mg /kg的剂量将博来霉素溶解在50μL生理盐水中。动物麻醉后固定在手术板上(手术板或者泡沫板120°左右放置和固定),前门牙用橡皮筋钩在垂直网格支撑上以保持气管呈直线,使用带有橡胶涂层的镊子轻轻夹住动物的舌头并将其移开,暴露气管区域,用另一只手将留置针尽可能平行于气管插入,然后将注射器连接留置针,把50μL 博来霉素溶液注射进小鼠肺部,给药后保持同一体位约1分钟[7]。

图2 模型构建方案
PART 03
关键数据
小鼠体重变化
博来霉素造模后,动物体重有明显下降,后续体重逐渐恢复并趋于稳定,整体状态良好。
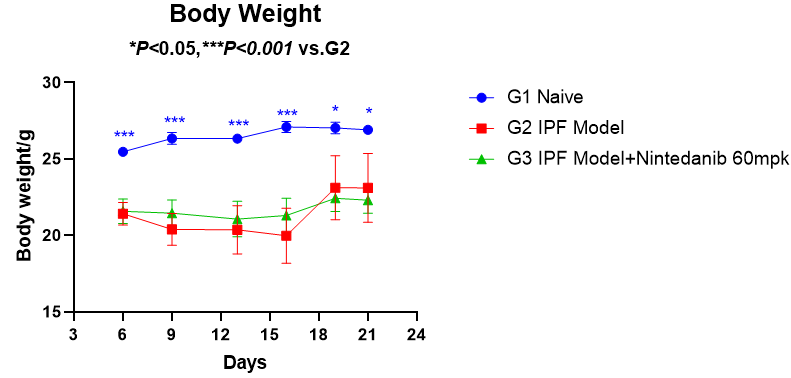
图3 体重和体重变化
肺组织羟脯氨酸含量
如图4所示,模型组小鼠肺组织中的羟脯氨酸含量显著增加,60mg/kg尼达尼布可明显降低肺组织羟脯氨酸的含量。
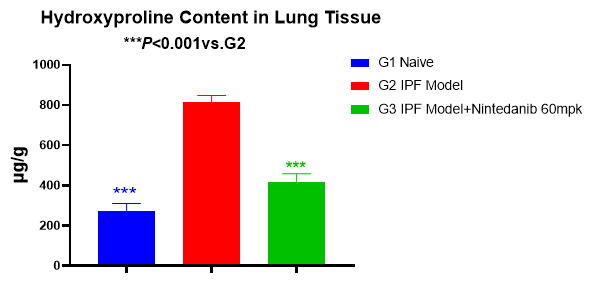
图4 肺组织羟脯氨酸含量
肺组织炎症
如图5所示,模型组小鼠肺组织炎症浸润的面积显著增加,60mg/kg尼达尼布可以显著减少肺组织的炎症浸润面积。
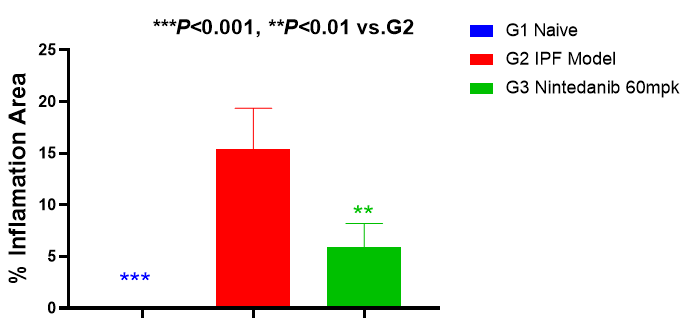
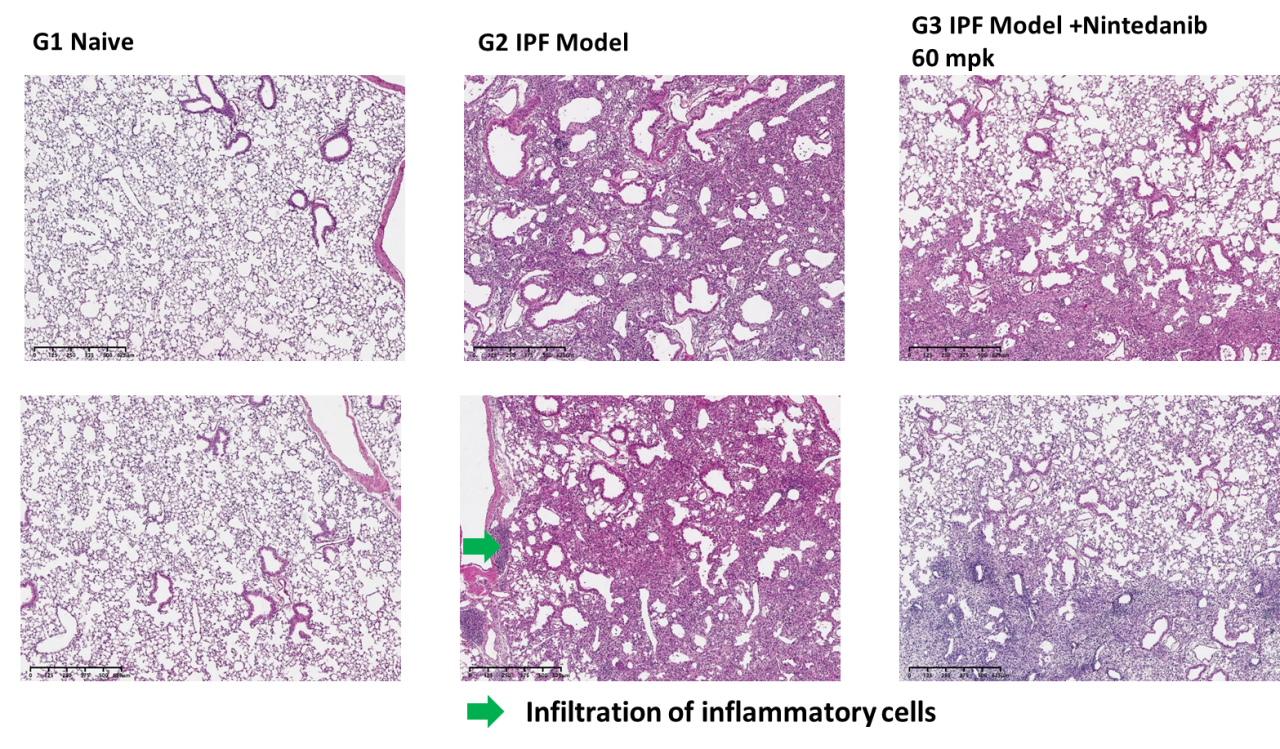
图5 肺部炎症面积和H&E染色代表图像
肺组织纤维化和Aschroft 评分
如图6和图7所示,模型组小鼠肺纤维化面积和Aschroft评分显著性增加,60mg/kg尼达尼布可明显降低肺纤维化面积和Aschroft评分。
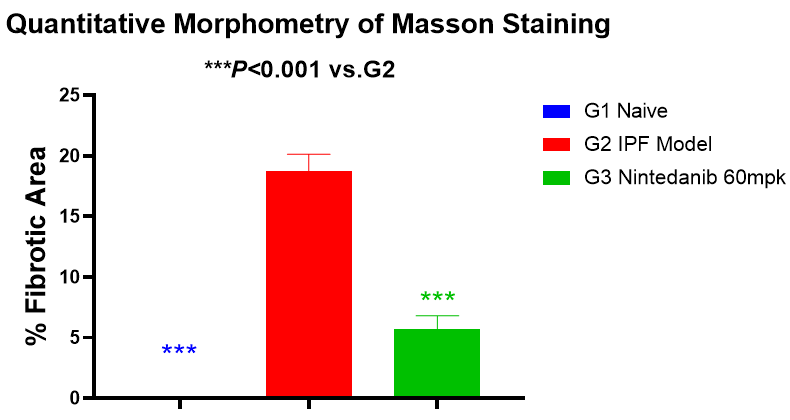

图6 肺部纤维化面积%和马松染色代表图像
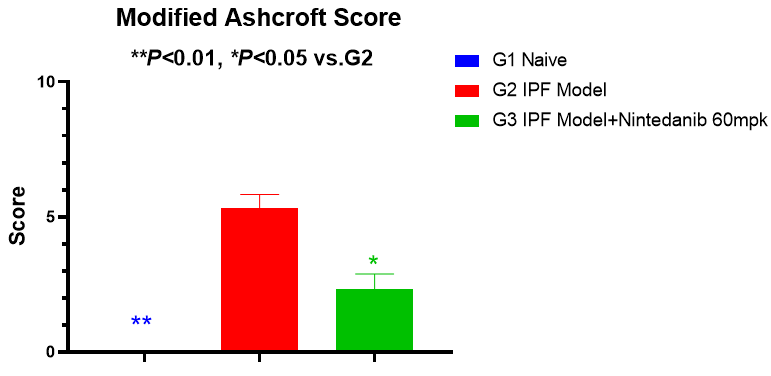
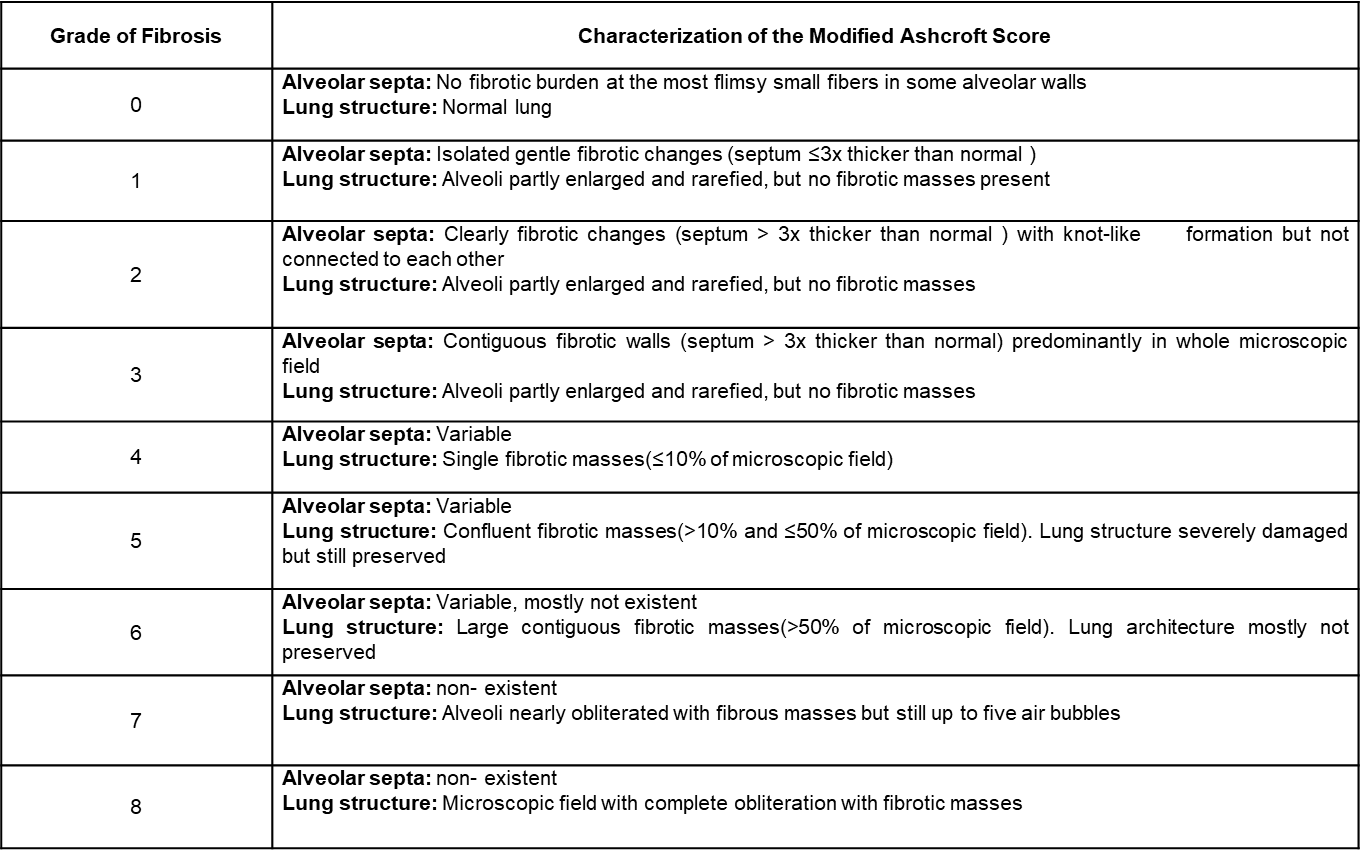
图7 Modified Ashcroft Score[8]
肺组织α-SMA含量
如图8所示,模型组小鼠肺组织中α-SMA面积显著增加,60mg/kg尼达尼布可以显著降低肺部α-SMA的含量。
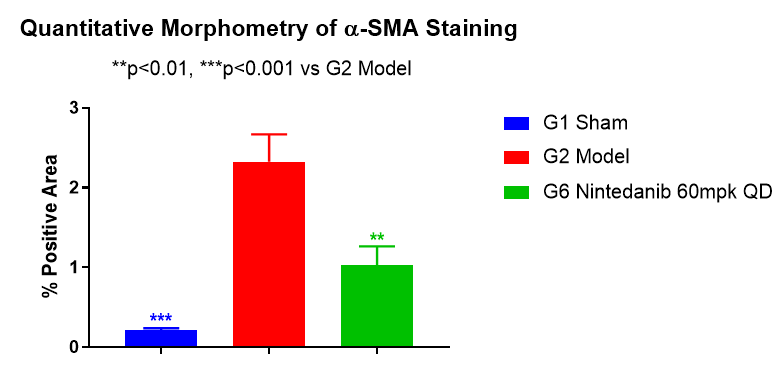
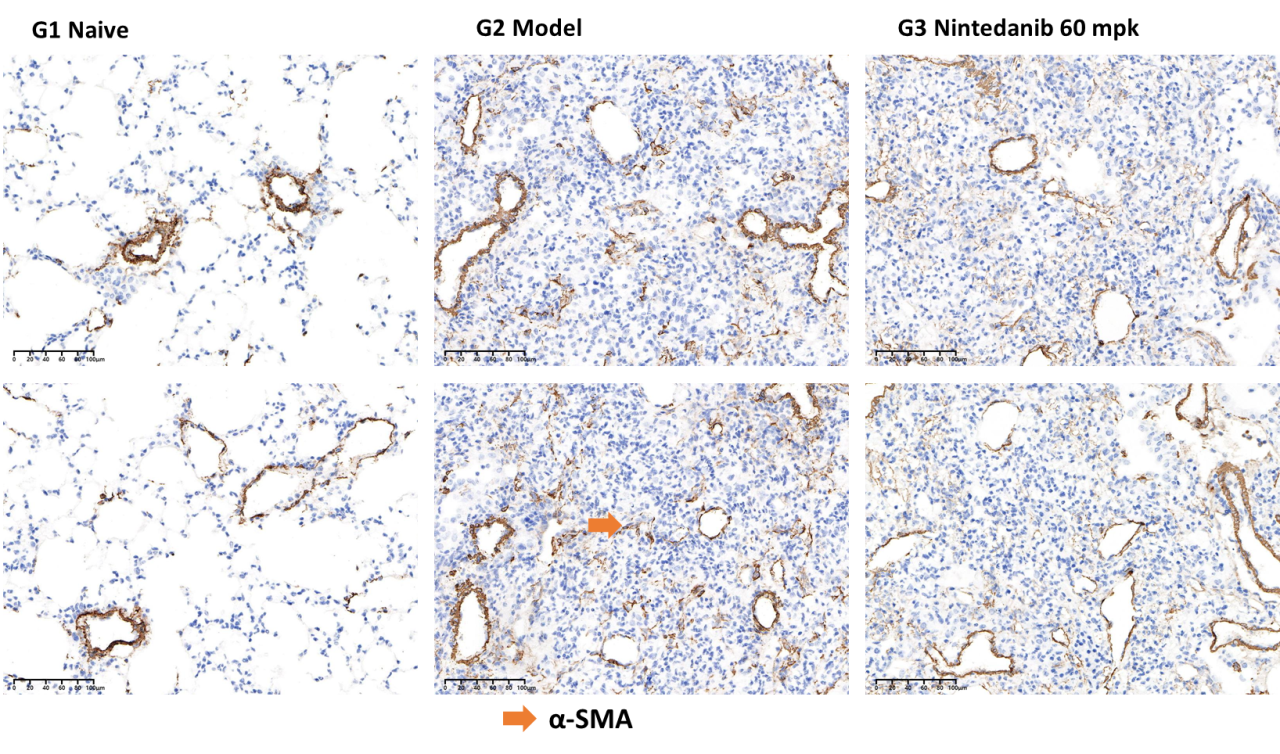
图8 肺部α-SMA染色面积%和α-SMA染色代表图像
实验结论
IPF模型组肺组织中羟脯氨酸含量、炎症浸润、纤维化、Ashcroft评分和α-SMA含量显著增加,较好地模拟了临床患者的病理表现,与文献报道基本一致。60mg/kg尼达尼布干预14天后,可以显著改善上述指标,减缓肺纤维化症状,表明该模型可用于评估IPF治疗药物的疗效评价。
在炎症和自身免疫疾病领域,熙宁生物|精翰生物临床前药理部门已经建立了完善的动物模型库(200+),可以为客户提供丰富的药物评价动物模型,包括炎症和自免疾病(皮肤疾病、关节炎、多发性硬化、红斑狼疮、葡萄膜炎、肠炎等)、纤维化(肺纤维化、肝纤维化、皮肤纤维化、肾纤维化)、肺部疾病(肺纤维化、哮喘、过敏性鼻炎、急性肺损伤 )、代谢系统疾病(NASH、肥胖、糖尿病肾病、肝纤维化)、肾脏疾病模型(急性肾损伤、慢性肾损伤、肾纤维化、糖尿病肾病、IgA肾病)、疼痛(炎性疼痛、神经性疼痛、偏头疼、术后疼痛、关节疼痛、骨痛)、神经退行性疾病(AD、PD)。在重点聚焦炎症和自身免疫疾病领域的同时,也可根据客户需求,提供相应的模型定制服务。
欢迎后台留言咨询。
参考文献:
[1] Mei Q, Liu Z, Zuo H, Yang Z, Qu J. Front Pharmacol. 2022;12:797292.
[2] Li M, Huang H, Wei X, et al. Signal Transduct Target Ther. 2025;10(1):235.
[3] Karampitsakos T, Juan-Guardela BM, Tzouvelekis A, Herazo-Maya JD. EBioMedicine. 2023;95:104766.
[4] Liu Z, Zheng Q, Li Z, et al. EBioMedicine. 2025;112:105538.
[5] B Moore B, Lawson WE, Oury TD, Sisson TH, Raghavendran K, Hogaboam CM. Am J Respir Cell Mol Biol. 2013;49(2):167-179.
[6] Kim DH, Kim HC, Im K, et al. Eur Respir J. 2025;65(6):2400615.
[7] Ortiz-Muñoz G, Looney MR. Bio Protoc. 2015;5(12):e1504.
[8] Hübner RH, Gitter W, El Mokhtari NE, et al. Biotechniques. 2008;44(4):507-517.