



嵌合抗原受体T细胞(Chimeric Antigen Receptor T Cell,CAR-T)治疗产品因其在血液肿瘤中的显著疗效,已成为国际肿瘤免疫治疗研究领域中的新热点,也成为治愈肿瘤的新希望。
但是,在CAR-T细胞产品的生产中存在复制型病毒(Replication Competent Virus,RCV)污染的潜在风险,监管机构要求对于临床使用的慢病毒或逆转录病毒载体,转导的CAR-T细胞产品和患者均要进行复制型病毒的检测。
PART 01
什么是复制型病毒?
在CAR-T细胞治疗产品的制备过程中,通常利用慢病毒载体或逆转录病毒载体将CAR基因高效地导入T细胞中,但在使用这些病毒载体的同时也带来了CAR-T产品污染复制型逆转录病毒(Replication Competent Retrovirus,RCR)或复制型慢病毒(Replication Competent Lentivirus,RCL)的潜在风险。RCL和RCR都可以称为复制型病毒(RCV),RCV通过病毒载体回复突变产生,是具有复制能力的病毒。
PART 02
复制型病毒对患者有哪些安全性风险?
RCL/RCR对患者的风险表现在两个方面:
(1)它们同逆转录病毒载体一样可以整合在细胞基因组中,这种整合可能使得一种能够激活原癌基因,破坏抑癌基因或使促细胞生长的因子表达增高,从而增加二次肿瘤的风险;
(2) 因其具有复制性,即可产生具有复制能力的病毒,加之采用了可感染多种细胞的膜蛋白,大大增加了整合造成二次肿瘤的风险。
尽管在逆转录病毒载体或慢病毒载体发展的过程中,研究者一直在采取多种措施(包括载体的设计、病毒载体包装方法等)以降低RCR/RCL的风险,基本消除了RCL重组产生的可能性,但仍不能完全排除污染的风险,因此RCL/RCR的污染风险始终是药品监管机构一个重要的关注点。
PART 03
复制型病毒是如何产生的?
目前,制备CAR-T细胞所用的慢病毒载体和γ-逆转录病毒载体均为复制缺陷型载体,这在理论上大幅降低了产生复制型病毒的风险。然而,在病毒载体的制备方法以及制备过程中,仍存在产生RCL或RCR的潜在风险。这些风险主要来自于在病毒载体生产过程中,穿梭质粒、包装质粒及包装细胞中的内源性逆转录元件之间,或病毒载体与T细胞的内源性逆转录元件之间,发生的同源或非同源重组。
由此可见,RCV可能产生在病毒载体生产阶段,也可能产生在CAR-T细胞制备阶段。并且在患者接受治疗后,随着CAR-T细胞在体内的持续扩增,也依然存在产生RCV的潜在风险。
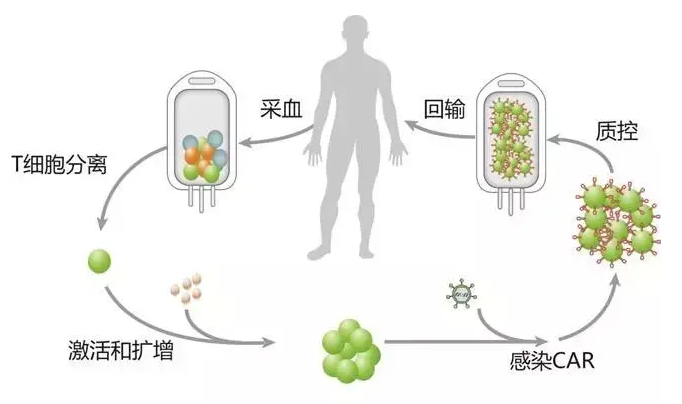
图1 细胞治疗产品生产流程
PART 04
复制型病毒的监管要求
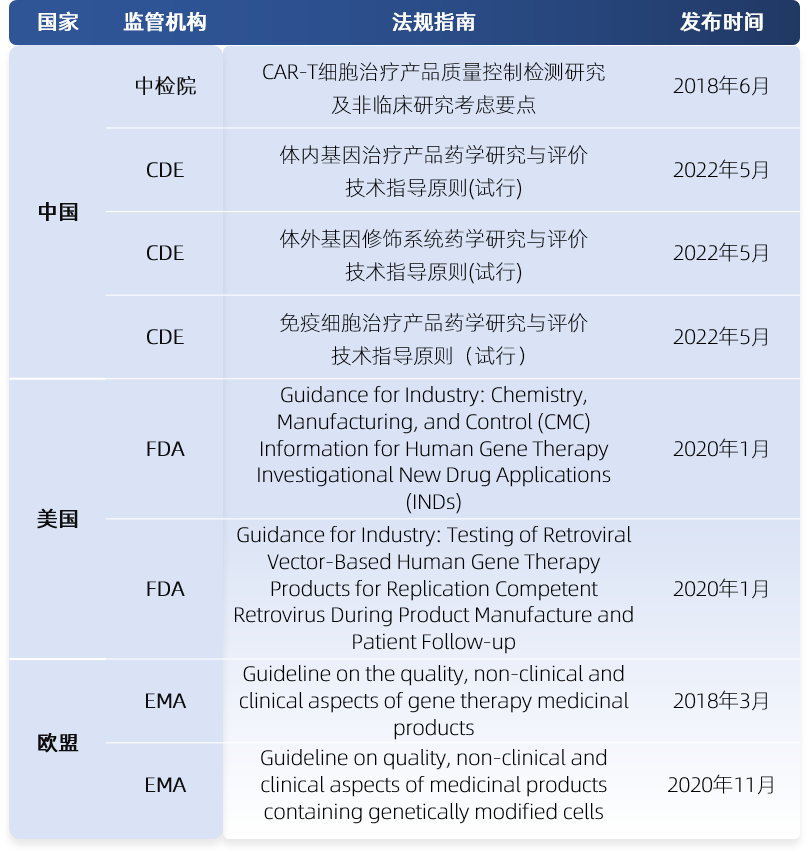
针对RCV的风险,中国、美国及欧洲的药品监管机构均发布了明确的指导原则,要求在病毒载体的设计上应尽可能降低与野生型病毒相关的任何致病性,并尽可能将病毒重组和回复突变的风险降到最低。同时,在产品的生产和应用的不同阶段进行RCL的控制,以保障患者的用药安全。相关法规指南如下:
表1 复制型病毒相关的法规指南
PART 05
RCR/RCL检测的方法
《CAR-T细胞治疗产品质量控制检测研究及非临床研究考虑要点》提到,目前RCR/RCL的检测方法主要有指示细胞培养法、ELISA法(p24蛋白测定)、PCR/qPCR法(通过psi-gag或VSV-G聚合酶链反应)和转录酶活性测定法(PERT)等。其中,qPCR法因其具有检测时间短、环境条件简单、灵敏度高和可重复性强等优点,被许多CAR-T申报企业作为快速放行方法。
熙宁生物|精翰生物目前已独立建立了多种qPCR检测RCL/RCR的方法,检测的目标基因涵盖慢病毒载体包膜VSV-G、逆转录病毒载体包膜GALV,以及猫内源性逆转录病毒RD114等,最低灵敏度能够达到2或5拷贝数/反应。此外,我们还与合作伙伴共同建立了基于细胞培养法的RCL检测方法。以上提及的多种方法均已进行验证,可供申办方直接使用。
欢迎后台留言咨询。