



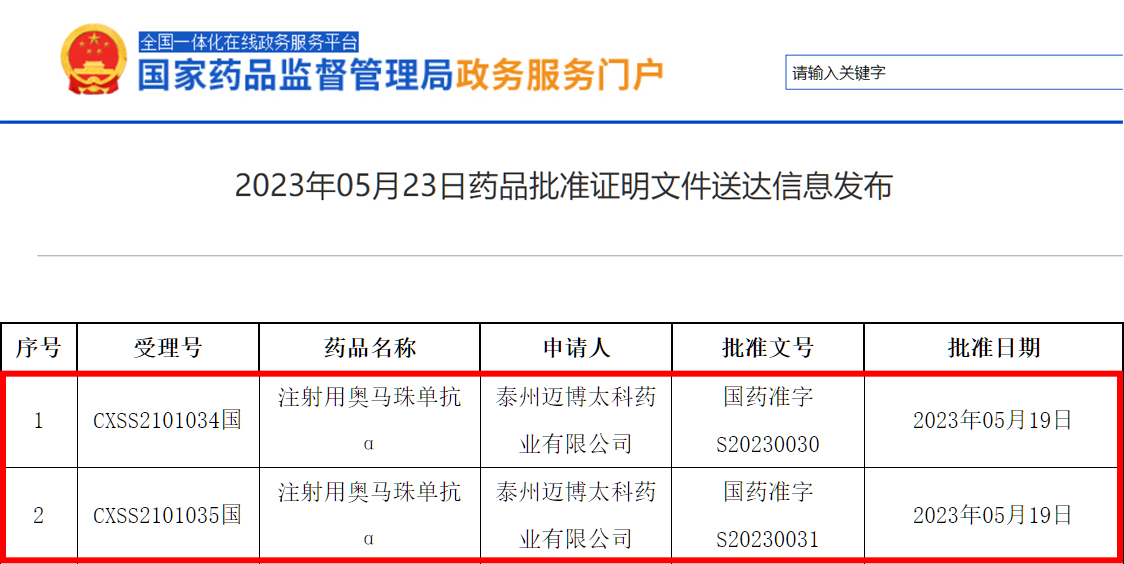
5月23日,中国国家药品监督管理局网站公示
近日,迈博药业有限公司(香港联交所上市公司,股份代码:2181.HK)附属公司泰州迈博太科药业有限公司开发的CMAB007(注射用奥马珠单抗α)正式获得中国国家药品监督管理局(以下简称“ 国家药监局”)上市许可批准,用于治疗确诊为免疫球蛋白E("IgE")介导的哮喘患者,为中国首个获国家药监局批准的国产过敏性哮喘治疗性抗体新药。
CMAB007 的安全性及疗效已经由共4 项临床试验,合共824 名受试者接受CMAB007 给药的结果所证实,该等试验为中国规模最大的治疗哮喘的单克隆抗体临床试验。同时迈博药业的临床试验结果显示,CMAB007 能以较低剂量的吸入糖皮质激素改善哮喘病人的病情及降低急性哮喘发病的概率。
熙宁生物积极助力CMAB007的获批上市

感谢信
熙宁生物为泰州迈博太科药业有限公司开发的CMAB007 在临床项目CMAB007-002 中提供了准确可靠的药代动力学(PK)、抗药抗体(ADA)、中和抗体(NAb)、药效学生物标志物(总IgE 和游离IgE)样品分析检测服务,结果显示CMAB007的药代动力学、免疫原性和药效指标符合国家药监局药物注册标准,积极助力CMAB007 的获批上市。

迈博药业专注于抗体药物研发,拥有资深的研发团队,核心成员在抗体药物开发领域拥有超过20 年经验;拥有多项核心技术、国内领先的大规模抗体制备体系和卓越的质量管理体系。迈博药业的产品管线目前包括多个单克隆抗体药物。除CMAB007 外,CMAB008 类停®(注射用英夫利西单抗)已获准上市,CMAB009(西妥昔单抗)已向国家药监局提交新药上市申请。
熙宁生物是一家以分析科学为核心能力,专注于为生物新药临床与临床前研究提供专业技术服务的创新型CRO企业。公司主营业务包括符合国际GLP&GCP质量管理规范的生物分析(Bioanalysis,BA)服务,生物标志物(Biomarker)研究与伴随诊断(Companion Diagnostics,CDx) 产品开发服务,以及临床前药理药效研究(Pre-clinical Pharmacology)服务。
一站式的生物分析服务包括分析方法学的开发验证和生物样本分析,以及抗体制备和细胞株构建,临床样本采集包制备和实验室手册撰写等支持服务。涵盖包括细胞与基因治疗产品(CGT)在内的各类新型生物制品临床及临床前研究的药代动力学(PK),药效学(PD),抗药抗体(ADA),中和抗体(NAb),以及各类有效性、安全性相关检测。
全面的生物标志物研究服务基于免疫组化(IHC)、细胞学及流式细胞术(FACS) 、免疫学、液质联用(LC-MS)、二代测序(NGS)及基因检测(qPCR/ddPCR)等技术平台,可实现对组织、细胞、蛋白、分子、基因各个样本水平的全覆盖。伴随诊断产品开发依托丰富的生物标志物研究经验,可提供的技术服务包括LDT方法学开发、CDx产品开发及验证、注册检验、临床试验研究和注册申报,委托生产等。
非临床研究服务包括动物模型的建立,以及基于动物模型(in vivo)、离体(ex vivo)、体外(in vitro)药理药效学研究、组织病理学研究(Pathology)、功能细胞株构建和产品放行检测等。
公司成功支持了国内第一款Ⅰ类新药CAR-T产品-药明巨诺倍诺达®(瑞基奥仑赛注射液)的上市。目前,公司已经和国内、国际超过100家生物制药企业或生物科技公司建立了项目合作,涵盖肿瘤免疫、自身免疫及代谢类疾病等多个热门治疗领域,包含蛋白药物,细胞及基因治疗药物等各类新药。截止2022年底,已支持双/多特异性抗体超过32个,细胞及基因治疗药物超过30个,在研靶点超过80个,临床试验(包含国际临床研究)超过360项。
公司在宁波(熙宁生物)、上海(精翰生物)、和美国新泽西(Accurant Bio)都建有实验室,总面积超过10,000 平方米。团队规模超过300人,其中超过30%拥有5-20年的专业工作经验,科学家团队超过50%拥有博士或硕士学位。
公司科学家团队曾参与了《中国药典》2015版“生物样品分析方法验证指导原则”、NMPA 2021年版《药物免疫原性研究技术指导原则》、及国际上多个行业白皮书的撰写;支持了500多项临床及临床前研究,含200多项全球多中心临床试验,多次成功通过FDA、EMA、OECD、NMPA的审计。